28、(14分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
 Ⅰ、将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2 2Fe2O3
+ 8SO2
Ⅰ、将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2 2Fe2O3
+ 8SO2

Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:

|
III、测定铁元素含量的实验步骤如图所示。

问题讨论:
(1)I中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有______
___________。
(2)II中,所加H2O2溶液(氧化剂)需足量的理由是__________。
(3)该黄铁矿中硫元素的质量分数为__________。
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?_______,理由是:_______。
(5)III的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________。
2010年安庆市高三第二学期重点中学联考
27、(14分)氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如图所示。
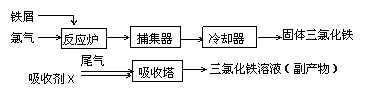
(1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为____________。
(2)下表是六水合氯化铁在水中的溶解度。
六水合氯化铁的溶解度
|
温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
|
溶解度 /(g/100g H2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是_______________。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的分子式为:______
(4)吸收剂X是________;吸收塔中吸收剂X的作用是________。
(5)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol/L Na2S2O3溶液滴定(I2+2S2O32- = 2I- + S4O62-),共用去V mL.则样品中氯化铁的质量分数为____________。
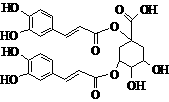 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是
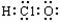
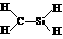 D.质量数为137的钡原子:
D.质量数为137的钡原子: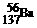
 2H2↑+O2↑
2H2↑+O2↑  2H2↑+O2↑
2H2↑+O2↑
 CO+3H2
CO+3H2