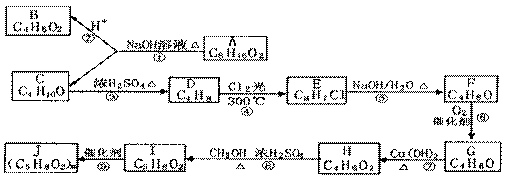
26. (12分)合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。 可以生产被称为21世纪的新型燃料--甲醇、二甲醚(CH3OCH3)等物质。其工艺流程如下:
(12分)合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。 可以生产被称为21世纪的新型燃料--甲醇、二甲醚(CH3OCH3)等物质。其工艺流程如下:
(1)写出用合成气生产二甲醚的化学方程式 。
 (2)尾气循环中涉及到以下反应:CH4(g)+H2O(g) CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式
。
(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g) CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式
。
(3)工业上一般采用下列两种反应合成甲醇:
 反应Ⅰ: CO(g)+2H2(g)
CH3OH(g)
反应Ⅰ: CO(g)+2H2(g)
CH3OH(g) 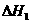
 反应Ⅱ:CO2(g)+3H2(g)
CH3(g)+H2O(g)
反应Ⅱ:CO2(g)+3H2(g)
CH3(g)+H2O(g)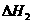
①下表所列数据是反应在不同温度下的化学平衡常数(K)。
|
温度 |
250 |
300 |
350 |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断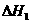 0(填“>”、“=”、“<”)。
0(填“>”、“=”、“<”)。
②已和:
CH3OH(g)+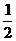 O2(g)
O2(g) CO2(g)+2H2(g) 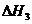 =-192.9kJ·mol-1
=-192.9kJ·mol-1
H2(g)+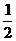 O2(g)
O2(g) H2O(g) 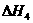 =-241.8kJ·mol-1
=-241.8kJ·mol-1
则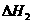 =
。
=
。
(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池。写出该电池负极的电极反应式 。
25.(15分)以下是一些元素的信息,其中有一种元素不在短周期。根据信息完成问题:
|
元素A |
元素B |
元素C |
元素X |
元素Y |
元素Z |
|
单质是一种常见金属,与元素X形成黑色和砖红色两种化合物 |
单质是一种黄绿色气体 |
短周期中金属性最强,与X反应能生成两种化合物 |
最外层电子数是内层电子数的3倍,能形成双原子阴离子 |
单质为双原子分子,结构中 键与 键与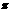 键数目比为1:2 键数目比为1:2 |
阳离子就是一个质子 |
(1)写出A元素基态原子的核外电子排布式 。
(2)B、C、X的简单离子半径由大到小的顺序为 (用元素离子符号表示)。
(3)化合物YZ4B化学键的类型是 ,检验该固体化合 物中阳离子的实验的方法和现象是 。
(4)A元素的单质在潮湿空气中锈蚀生成绿色物质,用一个化学方程式表示锈蚀过程 。
(5)常温下,工业上用惰性电极在电解槽中电解100 L 1.5mol·L-1CB的水溶液时,两极共收集到气体22.4L(标准状况下),计算电解后阴极区溶液的pH= (假设电解前后溶液体积不变)。
9.如图所示,利用培养皿进行实验。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。
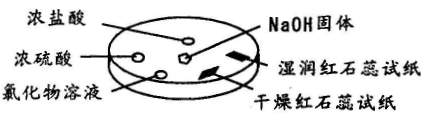
下表中对实验现象所做的解释不正确的是 ( )
|
选项 |
实验现象 |
解释 |
|
A |
浓盐酸附近产生白烟 |
NH3与HCI反应产生了NH4CI固体 |
|
B |
浓硫酸附近无白烟 |
NH3与浓硫酸不发生反应 |
|
C |
干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 |
NH3与水反应生成了NH3.H2O,电离出OH一使红色石蕊试纸变蓝 |
|
D |
氯化物溶液变浑浊 |
可能是AICI3与NH3反应生成AI(OH)3 |

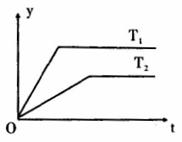 在一密闭容器中充人4 mol SO2和一定量O2,发生反应:
在一密闭容器中充人4 mol SO2和一定量O2,发生反应: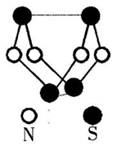 现代无机化学对硫一氮化合物的研究是最为活跃的
现代无机化学对硫一氮化合物的研究是最为活跃的 N键能
N键能