1.A和B是同周期相邻的元素,A和C是同主族相邻的元素,已知三种元素的核电荷数之和为33,则A可能为(多选)( )
A.S B.O
C.Si D.C
[解析] 因为题目中A和B是同周期相邻的元素,原子序数A大于B还是A小于B都有可能,类似的A和C同主族,原子序数也可能A大于C或A小于C,所以画出四种元素在周期表中的各种可能相对位置后分别进行计算。
①
|
B |
A |
|
|
C |
②
|
A |
B |
|
C |
|
③
|
C |
|
|
A |
B |
④
|
|
C |
|
B |
A |
设A的原子序数为x,按A+B+C的顺序分别计算如下:
①x+(x-1)+(x+8)=33,x=26/3,不合理;
②x+(x+1)+(x+8)=33,x=8,A为氧元素;
③x+(x+1)+(x-8)=33,x=40/3,不合理;
④x+(x-1)+(x-8)=33,x=14,A为硅元素。
[答案] BC
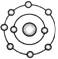 。下列原子中,与氟元素原子的化学性质相似的是( )
。下列原子中,与氟元素原子的化学性质相似的是( )
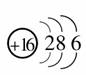 ,为硫元素;Y原子最外层电子数是次外层电子数的2倍,说明Y只有2个电子层,且最外层有4个电子,Y为碳元素;Z的氢化物水溶液显碱性,中学阶段要求掌握的碱性气体只有NH3,因此Z为氮元素;W的最高正价为+7,而F元素无正价,因此W为氯元素。
,为硫元素;Y原子最外层电子数是次外层电子数的2倍,说明Y只有2个电子层,且最外层有4个电子,Y为碳元素;Z的氢化物水溶液显碱性,中学阶段要求掌握的碱性气体只有NH3,因此Z为氮元素;W的最高正价为+7,而F元素无正价,因此W为氯元素。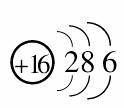 (2) 146C
(2) 146C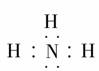 (3)HNO3 H2CO3
(3)HNO3 H2CO3 。
。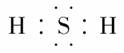
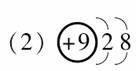 (3)CO (4)H3O+
(3)CO (4)H3O+