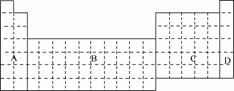
11.(2009·安徽合肥高三质检)有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
|
元素编号 |
元素特征信息 |
|
A |
其单质是密度最小的物质 |
|
B |
阴离子带两个单位负电荷,单质是空气的主要成分之一 |
|
C |
其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
|
D |
其氢氧化物和氧化物都有两性,与C同周期 |
|
E |
与C同周期,原子半径在该周期最小 |
回答下列问题:
(1)写出下列元素的名称:C________,E________.
(2)写出A、B、C形成的化合物的电子式________.
(3)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)______________________________________.
(4)①写出E单质与A、B、C形成的化合物反应的化学方程式:
____________________________________.
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式:
____________________________________.
③B、C元素形成的化合物与A2B反应的两个化学方程式:
______________________________________.
解析:根据题目信息可推断:A为氢,B为氧,C为钠,D为铝,E为氯.
(3)三者具有相同的核外电子排布式,核电荷数越大,离子半径越小,即离子半径:r(O2-)>r(Na+)>r(Al3+).
(4)①Cl2+2NaOH===NaCl+NaClO+H2O
②2Al+2OH-+2H2O===2AlO+3H2↑
③Na、O可形成Na2O和Na2O2,不要漏写.
答案:(1)钠 氯 (2)Na+[····H]-
(3)r(O2-)>r(Na+)>r(Al3+)
(4)①Cl2+2NaOH===NaCl+NaClO+H2O
②2Al+2OH-+2H2O===2AlO+3H2↑
③2Na2O2+2H2O===4NaOH+O2↑
Na2O+H2O===2NaOH
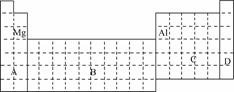
10.(2009·滨州一模)下图中a、b、c、d、e为周期表前四周期的部分元素,下列叙述正确的是
( )
|
|
|
|
|
a |
|
|
|
b |
|
|
|
c |
|
|
d |
|
|
|
e |
|
|
|
A.b元素除0价外,只有一种化合价
B.五种元素中,c元素的性质最稳定
C.b、d气态氢化物溶于水,溶液的酸性:b>d
D.e元素最高价氧化物的水化物和不同量的氢氧化钠反应,可能生成三种盐
解析:题干中明确指出a、b、c、d、e为周期表前四周期的元素,因此根据元素周期表的结构可确定a为He,b为O,c为Si,d为Cl,e为As.对于选项A,O元素除0价外,还有-2价、-1价、+2价等,A错;根据核外电子排布特点,5种元素中最稳定的元素应是稀有气体He,B错;b、d气态氢化物分别为H2O和HCl,显然C错;e元素最高价氧化物的水化物为H3AsO4,其性质应和H3PO4相似,是一种三元酸,能和碱反应生成两种酸式盐和一种正盐.
答案:D