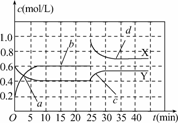
8.在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g
 CH3OH(g) ΔH<0.第2 min时只改变一个条件,反应情况如下表:
CH3OH(g) ΔH<0.第2 min时只改变一个条件,反应情况如下表:
|
时间 |
c(CO)/ mol/L |
c(H2)/ mol/L |
c(CH3OH)/ mol/L |
|
起始 |
1 |
3 |
0 |
|
第2 min |
0.8 |
2.6 |
0.2 |
|
第4 min |
0.4 |
1.8 |
0.6 |
|
第6 min |
0.4 |
1.8 |
0.6 |
下列说法不正确的是
( )
A.第4 min至第6 min该化学反应处于平衡状态
B.第2 min时,如果只改变某一条件,则改变的条件可能是降低温度
C.第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂
D.第6 min时,其他条件不变,如果升高温度,正反应速率增大
解析:第4 min-6 min,各组分的浓度不再改变,所以化学反应处于平衡状态,A正确;第2 min到第4 min反应速率比起始到第2 min的快,所以不可能是降低温度,可能是加入催化剂,故B错误,C正确;升高温度,不论吸热反应还是放热反应,其反应速率均增大,D正确.
 答案:B
答案:B