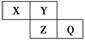
13.(2010×模拟题)有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
|
元素编号 |
元素特征信息 |
|
A |
其单质是密度最小的物质 |
|
B |
阴离子带两个单位负电荷,单质是空气的主要成分之一 |
|
C |
其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
|
D |
其氢氧化物和氧化物都有两性,与C同周期 |
|
E |
与C同周期,原子半径在该周期中最小 |
回答下列问题:
(1)写出C元素的名称:________,E元素最简单离子结构示意图为:____________。
(2)写出A、B、C形成的化合物的电子式____________。
(3)B、C、D的离子半径由大到小的顺序是(用化学式表示)________________。
(4)①E单质与A、B、C形成的化合物的水溶液反应的离子方程式为
________________________________________________________________________。
②D单质与A、B、C形成的化合物的水溶液反应的化学方程式为
________________________________________________________________________。
解析:由元素特征信息推测A为H元素、B为O元素、C为Na元素、D为Al元素、
E为Cl元素。代入问题逐一作答即可。
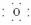 答案:(1)钠
答案:(1)钠 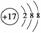 (2)Na+[ H]- (3)O2->Na+>Al3+
(2)Na+[ H]- (3)O2->Na+>Al3+
(4)①Cl2+2OH-===Cl-+ClO-+H2O ②2Al+NaOH+2H2O===2NaAlO2+3H2↑
11.(2010×原创题)如何利用实验室常见的药品试剂探究11-17号元素的金属性逐渐减
弱,非金属性逐渐增强?已知实验室有你想用到的仪器和药品、试纸等一切用品。
猜想与假设:(1)用________三种金属分别与水反应,通过观察生成气泡的速率便会
得出从________到________金属性减弱。
(2)因实验室不可能有硅单质,但可以测0.1 mol/L的________溶液和________溶液及
Na2SO4溶液的pH,推断三种盐溶液的水解情况,得出________、________、硫酸三
种最高价含氧酸的酸性强弱顺序是____________,从而得出从________到________
非金属性增强。
(3)制取饱和的氯水和饱和的氢硫酸溶液,用将____________________________方法,
通过________现象便直接得出非金属性S比Cl弱。
设计和实施方案:(1)用列表的方式(从实验方案、实验现象、有关化学方程式)完成你
的实验报告中的实验内容。
(2)实验结论是
_______________________________________________________________________。
(3)请你用物质结构理论知识解释结论。
解析:[问题]变换一个角度就是实验目的,也应是要得出的结论。根据[猜想与假设]
可以设计实验方案,关键细节要注意到,如镁条、铝条都要用砂纸擦后去氧化膜放入
沸水中。设计的方案尽量具有可操作性和简单性。
答案:猜想与假设:(1)钠、镁、铝 钠 铝
(2)Na2SiO3 Na3PO4 硅酸 磷酸 H2SiO3<H3PO4<H2SO4 Si S
(3)饱和氯水滴加到饱和氢硫酸溶液中的 溶液中有浅黄色沉淀生成的(或溶液变浑
浊)
设计和实施方案
(1)
|
实验方案 |
实验现象 |
有关化学方程式 |
|
用砂纸擦后的镁条、铝条分别投入到盛有沸水的小烧杯中,再分别滴加酚酞 |
投入镁条的试管有大量气泡产生,滴加酚酞后溶液变成浅红色;投入铝条的试管中无明显现象。 |
Mg+2H2O Mg(OH)2+H2↑ |
|
将一绿豆粒大小的钠投入到盛有冷水且预先滴有酚酞的小烧杯中 |
钠浮于水面上,迅速熔成闪亮小球四处游动,有响声,随之消失,溶液很快变红色 |
2Na+2H2O===2NaOH+H2↑ |
|
用玻璃棒分别蘸取0.1 mol/L的Na2SiO3(aq)、Na3PO4(aq)、Na2SO4(aq)测其pH |
Na2SiO3(aq)的pH比Na3PO4(aq)的pH大;Na2SO4(aq)的pH为7(中性) |
SiO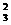 -+2H2O -+2H2O SiO3-+ SiO3-+OH- PO 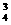 -+H2O -+H2O HPO HPO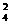 -+OH- -+OH- |
|
用胶头滴管向盛有5 mL饱和氢硫酸溶液的试管中滴加饱和的氯水 |
试管中有淡黄色沉淀生成(或溶液变浑浊) |
Cl2+H2S===2HCl+S↓ |
(2)金属性:Na>Mg>Al 非金属性:Si<P<S<Cl
(3)Na、Mg、Al、Si、P、S、Cl原子核外都有三个电子层,但最外层电子数依次为1、
9.(2010×温州一中期中考题)下列实验操作与实验目的相符的是( )
|
选项 |
实验操作 |
实验目的 |
|
A |
测定HF、HCl熔点、沸点 |
比较F和Cl的非金属性强弱 |
|
B |
MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 |
比较镁、铝的金属性强弱 |
|
C |
测定等浓度的Na2CO3、Na2SO3两溶液的pH |
比较碳、硫的非金属性强弱 |
|
D |
向氯化铵、氯化铝混合溶液中滴加氢氧化钠溶液至过量 |
比较氨水和氢氧化铝的碱性强弱 |
解析:A选项中熔沸点只与分子间作用力有关,与非金属活泼性没有关系;B选项均
生成白色沉淀,且最终沉淀不溶解,所以无法确定镁、铝的活泼性;C选项测定等浓
度的Na2CO3、Na2SO3两溶液的pH,只能说明碳酸与亚硫酸的酸性强弱,不能说明
碳酸与硫酸的酸性强弱,故不能选;D选项,滴加氢氧化钠溶液时,如果先产生沉淀
即说明氨水碱性强于氢氧化铝,否则反之。
答案:D
8.(2010×延安中学期中考题)现有短周期两种元素组成的甲、乙、丙、丁四种常温下呈气
态的化合物,它们的分子中所含电子数如下表所示:
|
分子代号 |
甲 |
乙 |
丙 |
丁 |
|
电子数 |
10 |
14 |
16 |
18 |
下列关于四种物质的推断中正确的是( )
A.四种气体中至少有两种气体分子互为同分异构体
B.四种气体通入溴的四氯化碳溶液中,都能使其褪色
C.实验室制备丙的关键条件是控制温度
D.气体丁中混有乙和丙两种气体,可以通入酸性高锰酸钾溶液中提纯气体丁
解析:依题意,相同的两种元素组成四种气体,只有碳、氢符合要求。根据分子中所
含电子数知,甲为甲烷、乙为乙炔、丙为乙烯、丁为乙烷。四种气体中只有甲烷与乙
烷互为同系物,A项错误;只有乙炔和乙烯能使溴的四氯化碳溶液褪色,B项错误;
实验室制乙烯时的温度控制在170℃,C项正确;酸性高锰酸钾溶液氧化乙烯、乙炔
会产生新杂质二氧化碳,故应用溴的CCl4溶液除去乙烷中的乙烯、乙炔气体杂质,
D项错误。
答案:C
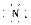
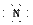 素;由元素E与C形成的化合物EC2可用于自来水的消毒,推出E为Cl元素。
素;由元素E与C形成的化合物EC2可用于自来水的消毒,推出E为Cl元素。 答案:(1)2 ⅤA Mg2+[ ]3-Mg2+[ ]3-Mg2+ (2)O2->Mg2+
答案:(1)2 ⅤA Mg2+[ ]3-Mg2+[ ]3-Mg2+ (2)O2->Mg2+
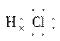 ;(3)若D有1层电子,D为He;若有2层电子,D为C元素;若有3层电子,D为S元素;根据D与Y相邻,判断D为S元素,由D与E可形成一种非极性分子,推断E为C。
;(3)若D有1层电子,D为He;若有2层电子,D为C元素;若有3层电子,D为S元素;根据D与Y相邻,判断D为S元素,由D与E可形成一种非极性分子,推断E为C。
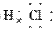 (3)S2-
(3)S2-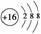 S=C=S H2S 2H2S+SO2===3S↓+2H2O
S=C=S H2S 2H2S+SO2===3S↓+2H2O