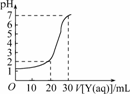
6.如图所示为对10 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度是下表内各组中的
( )
|
|
A |
B |
C |
D |
|
X(mol/L) |
0.12 |
0.04 |
0.03 |
0.09 |
|
Y(mol/L) |
0.04 |
0.12 |
0.09 |
0.03 |
解析:由图知,30 mL NaOH溶液恰好中和10 mL盐酸,即3Y=X,表中A、D属此种情况,但A组中X=0.12 mol/L,c(H+)=0.12 mol/L, pH<1,不符合图象,D组中X=0.09 mol/L, pH>1,加入20 mL NaOH后溶液的
c(H+)=
=1×10-2 mol/L, pH=-lg(1×10-2)=2,正好符合题意.
答案:D
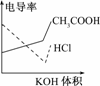
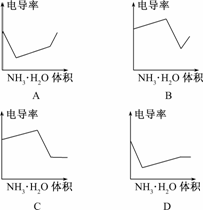
 HR+OH-.反应后所得溶液为HR和MR的混合液,根据电荷守恒有:c(H+)+c(M+)=c(R-)+c(OH-).因溶液呈酸性,所以HR的电离能力大于R-的水解能力,故有c(R-)>c(M+)>c(H+)>c(OH-).
HR+OH-.反应后所得溶液为HR和MR的混合液,根据电荷守恒有:c(H+)+c(M+)=c(R-)+c(OH-).因溶液呈酸性,所以HR的电离能力大于R-的水解能力,故有c(R-)>c(M+)>c(H+)>c(OH-).