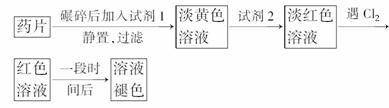
20.(8分)(2009·安徽合肥高三质检)等物质的量混合的NaHCO3和KHCO3的混合物4.60 g,与1.00 mol/L的盐酸反应.
(1)试分析,欲求标准状况下生成的CO2气体的体积,还需要什么数据________(用a表示,并注明单位).
(2)利用所确定的数据,求标准状况下CO2气体的体积(填写下表):
|
所需数据取值范围 |
生成CO2气体的体积 |
|
盐酸不足量时 |
|
|
盐酸足量时 |
|
(3)若NaHCO3和KHCO3的物质的量不相等,则4.60 g的混合物与足量盐酸完全反应时,标准状况下生成的CO2气体的体积大于________L,小于________L.
解析:(1)欲求标准状况下生成CO2气体的体积,还需知道盐酸的体积.(2)由题干数据知n(NaHCO3)=n(KHCO3)=0.0250 mol,则n(HCO)=0.0500 mol,当盐酸量不足时,n(HCl)<0.0500 mol,即a<0.0500 L;若盐酸足量,则a≥0.0500 L,产生CO2气体体积分别是27.4a L、1.12 L.
(3)当NaHCO3与KHCO3物质的量不相等时,若全部是NaHCO3产生CO2的量最多,当全部是KHCO3时,产生CO2的量最少,故生成CO2的体积 L<V< L,即1.03 L<V<1.23 L.
答案:(1)盐酸的体积a L
(2)
|
所需数据取值范围 |
生成CO2气体的体积 |
|
|
盐酸不足量时 |
a<0.0500 |
22.4a
L |
|
盐酸足量时 |
a≥0.0500 |
1.12 L |
(3)1.03 1.23