22.(8分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH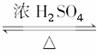 CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
 (1)欲提高乙酸的转化率,可采取的措施有________、________等.
(1)欲提高乙酸的转化率,可采取的措施有________、________等.
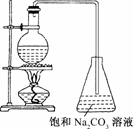
(2)若用右图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为________、________等.
(3)此反应以浓硫酸为催化剂,可能会造成________、________等问题.
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复作用.实验数据如下表所示(乙酸和乙醇以等物质的量混合).
|
同一反应时间 |
||
|
反应温度/℃ |
转化率(%) |
选择性(%)* |
|
40 |
77.8 |
100 |
|
60 |
92.3 |
100 |
|
80 |
92.6 |
100 |
|
120 |
94.5 |
98.7 |
|
同一反应温度 |
||
|
反应时间/h |
转化率(%) |
选择性(%)* |
|
2 |
80.2 |
100 |
|
3 |
87.8 |
100 |
|
4 |
92.3 |
100 |
|
6 |
93.0 |
100 |
|
*选择性100%表示反应生成的产物是乙酸乙酯和水 |
①根据表中数据,下列________(填字母)为该反应的最佳条件.
A.120℃, 4 h B.80℃, 2 h
C.60℃, 4 h D.40 ℃, 3 h
②当反应温度达到120℃时,反应选择性降低的原因可能为______________.
解析:(1)可以从化学平衡的角度来解决提高乙酸转化率的问题,如通过增大一种反应物的浓度可以提高另一种反应物的转化率,也可以通过及时分离出生成物的办法使化学平衡向正反应方向移动,从而提高原料的转化率.
(2)题中所提供的装置最大缺点是没有空气冷凝或水冷凝装置,会导致原料随反应物一起蒸出,使得产率降低.同时利用酒精灯直接加热不利于控制反应液的温度会导致副反应发生,如乙醇在浓硫酸的作用下发生脱水反应生成乙醚.
(3)以浓硫酸为催化剂的缺点可以从浓硫酸的性质、环境问题和能否循环利用等角度去分析.
(4)①根据实验数据表可知,温度不能太高,温度过高,引起副反应;温度过低,反应速率小,且不能将产物蒸馏出来;反应时间过长,不符合实验实际.选择条件的依据是选择性100%,转化率较高.适宜条件:60℃,4 h.
答案:(1)增大乙醇的浓度 及时分离出生成物
(2)温度过高,发生了副反应 冷凝效果不好,部分原料被蒸出(或部分产物挥发)
(3)部分原料炭化 留有酸性废液污染环境(或产生SO2污染环境) 催化剂重复使用困难 催化效果不理想(任填两种)
(4)①C ②乙醇脱水生成了乙醚