(二)选考题(共45分。请从给出的2道物理题、3道化学题、2道生物题中每科任选一题做答。)
11. [化学-选修化学与技术](15分)
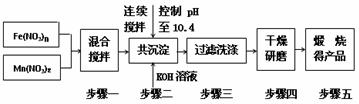 随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:
(1)原料Fe(NO3)n中n=______,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为______。
(2)步骤二中“连续搅拌”的目的是_________________________________________;
步骤三中洗涤干净的标准是_____________________________________________。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4  MnFe2O4-x +
MnFe2O4-x + 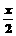 O2↑MnFe2O4-x
+ xH2O→MnFe2O4 + xH2↑,
O2↑MnFe2O4-x
+ xH2O→MnFe2O4 + xH2↑,
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为_______。
②该化学循环制氢的优点有(答两点即可)________________。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是_________。
12. [化学--选修物质结构与性质](15分)
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
|
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
|
B元素原子的核外p电子数比s电子数少1 |
|
C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
|
D原子核外所有p轨道全满或半满 |
|
E元素的主族序数与周期数的差为4 |
|
F是前四周期中电负性最小的元素 |
|
G在周期表的第七列 |
(1)已知BA5 为离子化合物,写出其电子式 .
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形.
 (3)某同学根据上述信息,推断C基态原子的核外电子排布为,
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了 .
(4)G位于 族 区,价电子排布式为 .
(5)DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
 (6)F元素的晶胞如右图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为
cm
(6)F元素的晶胞如右图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为
cm
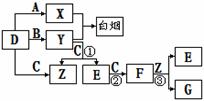
13. [化学--选修有机化学基础](15分)
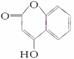
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
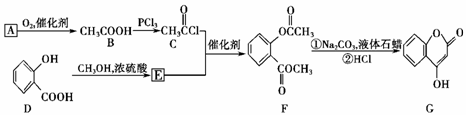
(1)A与银氨溶液反应有银镜生成,则A的结构简式是________。
(2)B―→C的反应类型是________。
(3)E的结构简式是________。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:_________________________。
(5)下列关于G的说法正确的是________。
a.能与溴单质反应 b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应 d.分子式是C9H6O3
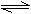 3H2+N2,测得NH3的分解率为x%。若在其他条件不变时,再充入lmol NH3,待建立新的平衡后,又测得NH3的分解率为y%,则x和y的正确关系为 ( )
3H2+N2,测得NH3的分解率为x%。若在其他条件不变时,再充入lmol NH3,待建立新的平衡后,又测得NH3的分解率为y%,则x和y的正确关系为 ( )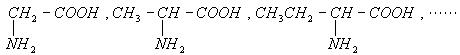
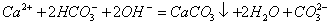
 2C6H5OH
+ 2CO32-
2C6H5OH
+ 2CO32-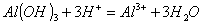 D.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
D.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
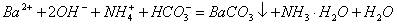
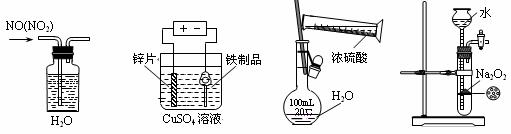
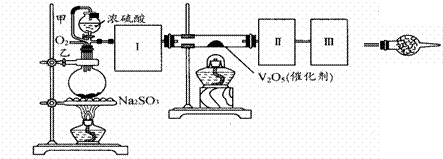 Na2SO3(s) + H2SO4(85%)==Na2SO4 + SO2↑+ H2O
Na2SO3(s) + H2SO4(85%)==Na2SO4 + SO2↑+ H2O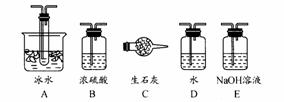
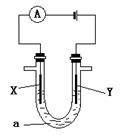 B.C(s)+ CO2(g)= 2CO(g) △H>O
B.C(s)+ CO2(g)= 2CO(g) △H>O