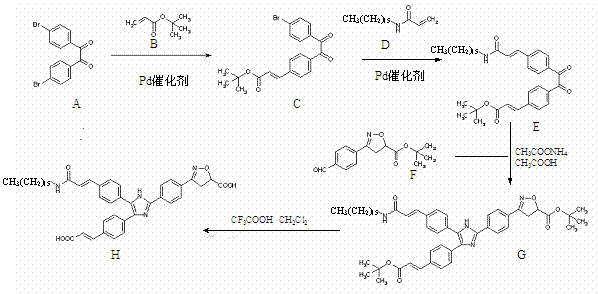
21.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.叠氮化钠(NaN3)是一种无色结晶,广泛用于汽车安全气囊及化工合成等。常见的两种制备方法为:
2NaNH2 + N2O = NaN3+NaOH+NH3 3NaNH2+NaNO3 =NaN3+3NaOH +NH3↑
(1)下列说法正确的是 ▲ 。
A.N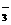 与N2O互为等电子体
与N2O互为等电子体
B.NaN3、NaNH2、NaOH、NaNO3均为离子化合物
C.NaNH2熔点(210℃)比NaOH 熔点(318.4℃)低,是因为前者相对分子质量小
D.第一电离能 N比O大
(2)NH3沸点(-33.34℃)比N2O沸点(-88.49℃)高,其主要原因: ▲ 。
(3)依据价层电子对互斥理论,NO3-空间构型呈 ▲ 形。
(4)一种叠氮桥基化合物,合成方法如下:
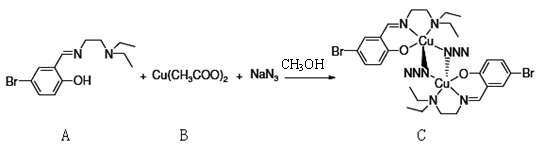

醋酸铜中,Cu2+在基态时核外电子排布式为: ▲ 。配合物C中,氮原子杂化方式有: ▲ 。
(5)汽车安全气囊是基于反应6NaN3 + Fe2O3  3Na2O +2Fe +9N2↑,铁的晶体有三种堆积方式,其中两种的堆积方式如下:
3Na2O +2Fe +9N2↑,铁的晶体有三种堆积方式,其中两种的堆积方式如下:
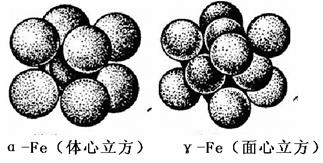
下列说法正确的是 ▲ 。
A. 空间利用率α-Fe大于γ-Fe
B. α-Fe、γ-Fe的堆积方式分别与铜和镁相同
C.金属铁的导电性是由于通电时自由电子作定向移动
D. α-Fe延展时,可以转变为γ-Fe
B.以苯酚为原料合成对羟基苯乙酮的原理如下:
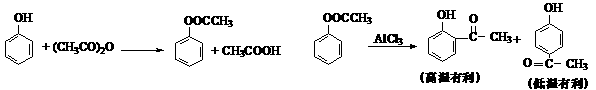
(1)乙酸苯酚酯制备:
将9.4 g苯酚溶解在60 mL10%的氢氧化钠溶液中,加入30g碎冰块,然后加入13.0 g乙酸酐,搅拌5 min。将反应后混合物倾入分液漏斗中,加入约4 mL CCl4。将有机相用试剂X和水洗涤然后无水CaCl2干燥,蒸馏收集193-197℃馏分。
①用碎冰块代替水可能的原因是: ▲ 。
②乙酸酐过量的目的是: ▲ 。
③有机相先用试剂X洗涤,X可能是 ▲ 。
(2)对羟基苯乙酮的制备:
将乙酰苯酚6.8 g,硝基苯20 mL 放在三口烧瓶中,搅拌下加入无水AlCl3 11 g(此时放热),加完后控制合适的温度,维持一定时间。然后冷却,倾入冰水中,用6mol/L HCl酸化分出硝基苯层,水层用氯仿萃取,蒸出氯仿得粗品。
①硝基苯的作用是 ▲ 。
②乙酸苯酚重排为对羟基苯乙酮反应条件对收率的影响关系如下表
|
反应温度/℃ |
反应时间(min) |
收率 |
|
30-35 |
180 |
10.0 |
|
20-25 |
60 |
18.0 |
|
20-25 |
120 |
26.0 |
|
20-25 |
180 |
58.5 |
适宜的温度是 ▲ ;反应时间是 ▲ 。
盐城市2010/2011学年度高三年级第二次调研考试
18.(12分) 丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的工艺流程如下:
|
序号 |
n(丙酸)∶n(碱式碳酸锌) |
反应 温度/℃ |
丙酸锌 产率/% |
|
1 |
1∶0.25 |
60 |
67.2 |
|
2 |
1∶0.25 |
80 |
83.5 |
|
3 |
1∶0.25 |
100 |
81.4 |
|
4 |
1∶0.31 |
60 |
89.2 |
|
5 |
1∶0.31 |
80 |
90.1 |
|
6 |
1∶0.31 |
100 |
88.8 |
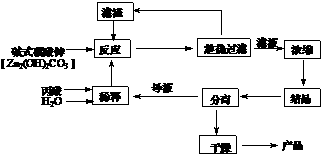
(1)碱式碳酸锌与丙酸反应的化学方程式为: ▲ 。
(2)本题采用趁热过滤的方式,其目的是: ▲ 。
(3)实验中用水量不易过少,其原因是 ▲ 。
(4)探究本实验中最佳工艺条件(见右上表):反应时间2h,用水量45g, n(丙酸)∶n(碱式碳酸锌)=1∶ ▲ ,反应温度 ▲ ℃。
(5)某次实验时,将37.0g丙酸溶于220mL水中,按上述流程在上述优化的条件下制备,最终得产品丙酸锌49.6g,则该次实验丙酸锌的产率为: ▲ 。
(6)本工艺“采用闭路循环”方式,除具有制备工艺简便、产率高外,还具有: ▲ 。
15.(12分)碱式碳酸镁密度小,是橡胶制品的优良填料。可用复盐MgCO3·(NH4)2CO3·H2O作原料制备。取一定量的含镁复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120 ℃干燥得到碱式碳酸镁产品。
(1)①搅拌的目的是 ▲ ,②选择水浴加热方式,其优点是: ▲ 。
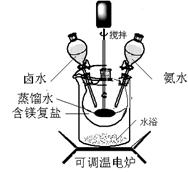 (2)40℃复盐开始热解生成MgCO3·3H2O,该反应的化学方程式为: ▲ 。
(2)40℃复盐开始热解生成MgCO3·3H2O,该反应的化学方程式为: ▲ 。
(3)40℃时,开始滴加卤水的目的是 ▲ 。
(4)碱式碳酸镁产品中镁的质量分数(w(Mg)%)越高,产品质量越好,氯的质量分数越高,产品质量越差。分析Cl-含量采用滴定法,先精确称取一定量产品用适量硝酸溶解,经稀释等步骤最终配得一定体积的溶液。
①测定实验中除用到天平、烧杯、玻璃棒、锥形瓶、滴定管外,还用到的玻璃仪器有: ▲ 。
②已知某温度时,一些银盐的Ksp如下表:
|
难溶盐 |
AgCl |
AgBr |
AgI |
Ag2CrO4 |
|
Ksp |
2×10-10 |
5.4´10-13 |
8.3´10-17 |
2×10-12 |
|
颜色 |
白色 |
淡黄色 |
黄色 |
砖红色 |
则滴定时,可用作指示剂的是 ▲ (选填序号:a.NaBr b.NaI c.K2CrO4)。且滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是 ▲ 。
(5)若已知制得的碱式碳酸镁的质量ag,要确定其组成(不考虑微量杂质),还必需的数据有: ▲ 。
①充分灼烧后,剩余固体的质量 ②灼烧时,测算得的二氧化碳的体积(已换算成标准状况)
③灼烧时的温度和时间 ④碱式碳酸镁的密度
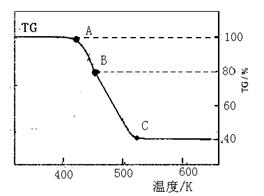 (2)将制得的产品在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。
(2)将制得的产品在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? ▲
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? ▲

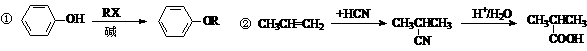

 (3)用铜棒作阳极,钛作阴极,电解氯化钠和氢氧化钠的混合溶液,电解总方程为:
(3)用铜棒作阳极,钛作阴极,电解氯化钠和氢氧化钠的混合溶液,电解总方程为: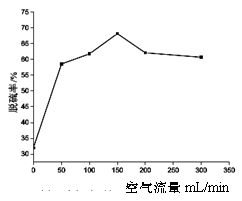 A.用正辛烷作溶剂进行实验,是为了模拟柴油的成分
A.用正辛烷作溶剂进行实验,是为了模拟柴油的成分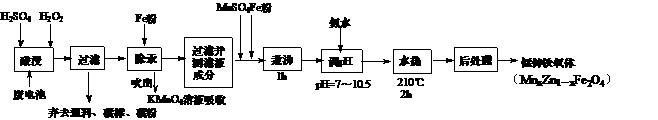 (1)当x=0.4,试用氧化物形式表示该铁氧体组成 ▲
。
(1)当x=0.4,试用氧化物形式表示该铁氧体组成 ▲
。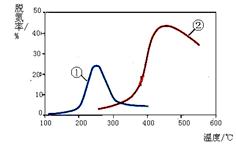 如右图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g)
+ NO2(g) + 2NH3(g)
如右图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g)
+ NO2(g) + 2NH3(g)  2N2(g) + 3H2O(g),相关说法正确的是
2N2(g) + 3H2O(g),相关说法正确的是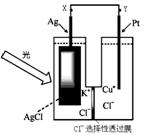 一种光化学电池的结构如右图,当光照在表面涂有氯化银的银片上时,AgCl(s)
一种光化学电池的结构如右图,当光照在表面涂有氯化银的银片上时,AgCl(s)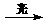 Ag(s)+Cl(AgCl),
[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态。下列说法不正确的是
Ag(s)+Cl(AgCl),
[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态。下列说法不正确的是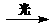 Ag(s) +Cu2+(aq)+Cl-
Ag(s) +Cu2+(aq)+Cl-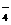 )+ c(H2C2O4)
)+ c(H2C2O4)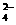 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)