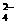5、下列实验操作完全正确的是( )
|
编号 |
实 验 |
操 作 |
|
A |
钠与水的反应 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
|
B |
配制一定浓度的氯化钾溶液1 000 mL |
准确称取氯化钾固体,放入到1 000 mL的容量瓶中,加水溶解,振荡摇匀,定容 |
|
C |
排除碱式滴定管尖嘴部分的气泡 |
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
|
D |
取出分液漏斗中所需的上层液化 |
下层液体从分液漏斗下端管口入出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
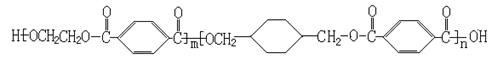
10、(15分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
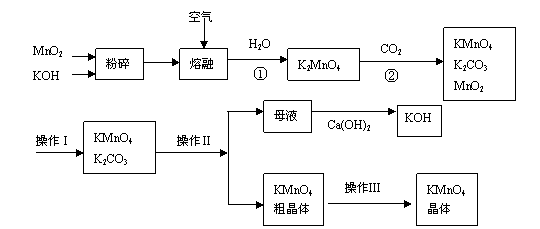

(1)操作Ⅰ的名称为__________;操作Ⅲ的名称为__________。
(2)反应②的化学方程式为 。
工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为 。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而 MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性。简述实验操作、现象及相关结论: 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO3=5Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 g Na2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 mL |
0.02 |
24.01 |
|
2 |
25.00 mL |
0.70 |
24.71 |
|
3 |
25.00 mL |
0.20 |
24.20 |
①.配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和__________________、_________________。
②.判断滴定终点的依据是_______________________________。
③.以下滴定过程的操作会使得所测Na2SO3的纯度偏高的是_________________。
A.滴定管在使用时未用标准液润洗
B.滴定前读数时仰视,滴定后读数时俯视
C.滴定前滴定管尖嘴中气有泡,滴定后气泡消失
D.锥形瓶中有少量水,直接放入待测液。
④.用上述实验数据,计算Na2SO3的纯度为__________________。
[根据江苏省金陵中学2010届高三高考模拟试卷15题改编]
(出题意图:第一小题考查的是学生对实验操作的合理应用。第二小题主要考的是化学方程式和电极方程式的书写。第三小题考的是实验操作的设计第四小题考查的是滴定实验的操作、误差分析和计算能力。)
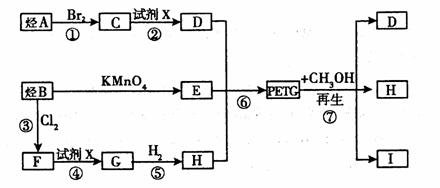
8、(12分)A-J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。
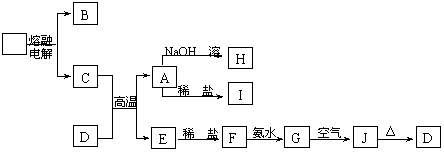 请回答下列问题:
请回答下列问题:
(1)A的化学式为 。
(2)H溶液中通入少量的CO2,其反应的离子方程式是 。
G→J的化学方程式为 。
 反应C+D→A+E在工业上的一个重要用途是 。
反应C+D→A+E在工业上的一个重要用途是 。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表
示所得溶液显酸性的原因 。
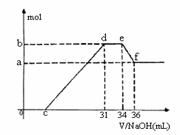
(4)现有一定量C、E混合物与稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol /L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如上图所示。坐标图c点溶液中溶质除C和E的硝酸盐外,还含有的溶质是___________________________,其对应物质的量为
。
[根据2008-2009学年江苏省通州市高三化学上学期第一次调研测试第18题改编]
(出题意图:本题考查无极推断,所涉及的知识点包括金属铝的制备及其化合物的性质,铝热反应的应用,铁的化合物的转化,离子方程式和氧化还原反应方程式的书写,盐类水解的应用,最后一小题考查学生利用电子得失守恒和元素守恒进行计算的能力。)
9(15分)、非金属元素氮有多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是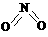 和
和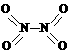 。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式_________________________________________
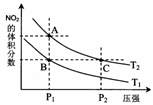 (2)对反应N2O4(g)
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
|
n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
|
n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____。
②该反应的平衡常数K的值为
;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正 v逆(填“>”、“<”或“=”),升高温度后,反应2NO2 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)[根据宁波市2009年高三模拟考试卷(理科综合能力)第27题改编]
(出题意图:第一小题让考生从化学键的角度计算反应热,从而领会化学反应的本质。第二小题主要考的是外界条件对化学反应速率和化学平衡影响的应用。第三小题考的是化学反应速率和混合气体平均相对分子质量的计算,等效平衡的简单计算以及化学平衡常数的应用,相对于原卷中化学平衡常数的应用难度有所提高。)
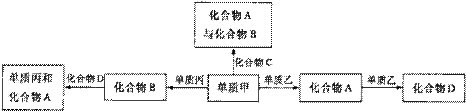 化合物A、B、C、D各由两种元素组成,甲、乙、丙是前两周期元素的三种单质。这些常见的化合物与单质之间存在如下关系(已知C是一种有机物),以下结论不正确的是( )
化合物A、B、C、D各由两种元素组成,甲、乙、丙是前两周期元素的三种单质。这些常见的化合物与单质之间存在如下关系(已知C是一种有机物),以下结论不正确的是( ) 生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示。已知C1极的电极反应方程式为:C2H5OH+3H2O-12e-=2CO2+12H+。下列说法不正确的是(
)
生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示。已知C1极的电极反应方程式为:C2H5OH+3H2O-12e-=2CO2+12H+。下列说法不正确的是(
)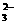 、SO
、SO