摘要:(二)选考题(共45分.请从给出的2道物理题.3道化学题.2道生物题中每科任选一题做答.) 11. [化学-选修化学与技术] 随着能源问题的进一步突出.利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现.复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢.MnFe2O4的制备流程如下: (1)原料Fe(NO3)n中n= .投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为 . (2)步骤二中“连续搅拌 的目的是 , 步骤三中洗涤干净的标准是 . (3)利用MnFe2O4热化学循环制氢的反应可表示为: MnFe2O4 MnFe2O4-x + O2↑MnFe2O4-x + xH2O→MnFe2O4 + xH2↑, 请认真分析上述两个反应并回答下列问题: ①若MnFe2O4-x中x=0.8.则MnFe2O4-x中Fe2+占全部铁元素的百分率为 . ②该化学循环制氢的优点有 . ③该热化学循环法制氢尚有不足之处.进一步改进的研究方向是 . 12. [化学--选修物质结构与性质] 现有七种元素.其中A.B.C.D.E为短周期主族元素.F.G为第四周期元素.它们的原子序数依次增大.请根据下列相关信息.回答问题. A元素的核外电子数和电子层数相等.也是宇宙中最丰富的元素 B元素原子的核外p电子数比s电子数少1 C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol D原子核外所有p轨道全满或半满 E元素的主族序数与周期数的差为4 F是前四周期中电负性最小的元素 G在周期表的第七列 (1)已知BA5 为离子化合物.写出其电子式 . (2)B基态原子中能量最高的电子.其电子云在空间有 个方向.原子轨道呈 形. (3)某同学根据上述信息.推断C基态原子的核外电子排布为. 该同学所画的电子排布图违背了 . (4)G位于 族 区.价电子排布式为 . (5)DE3 中心原子的杂化方式为 .用价层电子对互斥理论推测其空间构型为 . (6)F元素的晶胞如右图所示.若设该晶胞的密度为a g/cm3.阿伏加德罗常数为NA.F原子的摩尔质量为M.则F原子的半径为 cm 13. [化学--选修有机化学基础] 是一种医药中间体.常用来制备抗凝血药.可通过下列路线合成: (1)A与银氨溶液反应有银镜生成.则A的结构简式是 . (2)B―→C的反应类型是 . (3)E的结构简式是 . (4)写出F和过量NaOH溶液共热时反应的化学方程式: . (5)下列关于G的说法正确的是 . a.能与溴单质反应 b.能与金属钠反应 c.1 mol G最多能和3 mol氢气反应 d.分子式是C9H6O3
网址:http://m.1010jiajiao.com/timu3_id_433653[举报]
用霞石岩(主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下: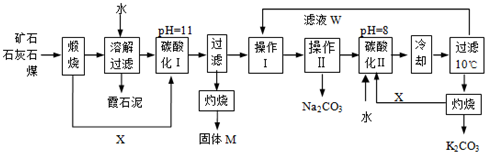
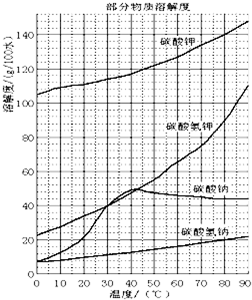
已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12.溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中.部分物质的溶解度见下图,根据题意回答下列问题:
(1)固体M的化学式是______,X物质是______.
(2)实验室进行煅烧操作时盛放固体物质的实验仪器是______,滤液W中主要含有的离子有______.
(3)碳酸化Ⅰ中发生主要反应的离子方程式是______.
(4)操作Ⅰ是______(填写名称),操作Ⅱ是______(选填编号).
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
(5)碳酸化Ⅱ调整pH=8的目的是______,产品K2CO3中最可能含有的杂质是______(写化学式).
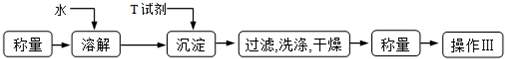
(6)实验室用下面流程测定产品碳酸钾的纯度,为提高实验精度,T试剂最好是______;操作Ⅲ的名称是______.
查看习题详情和答案>>
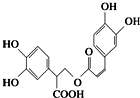 迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示.下列叙述正确的是(双选)( )
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示.下列叙述正确的是(双选)( )| A、迷迭香酸与溴单质能发生取代反应、加成反应 | B、1mol迷迭香酸最多能和9mol氢气发生加成反应 | C、迷迭香酸可以发生水解反应、取代反应和酯化反应 | D、1mol迷迭香酸最多能和5mol NaOH发生反应 |
设NA代表阿伏加德罗常数的值,下列叙述中正确的是( )
①常温常压下,1mol甲基(-CH3)所含的电子数为10NA;
②12g金刚石中含有的C-C键数为2NA;
③由Zn、Cu和稀硫酸组成的原电池工作时,若Cu极生成0.1g H2,则电路通过电子0.1NA;
④1mol Cl2发生反应时,转移的电子数一定是2NA;
⑤在标准状况下,11.2L NO与11.2L O2混合后气体分子数为0.75NA;
⑥常温常压下,14g由乙烯和丙烯组成的混合气体所含的原子数为3NA;
⑦标准状况下,22.4L水中含分子数为NA;
⑧1mol C10H22分子中共价键总数为31NA;
⑨在由氧元素和氟元素组成的化合物二氟化氧(OF2)中,氧呈+2价,氟显-1价,由此可推知氟的非金属性比氧强;
⑩2mol HF溶于水配成的溶液中含F-离子数为2NA.
①常温常压下,1mol甲基(-CH3)所含的电子数为10NA;
②12g金刚石中含有的C-C键数为2NA;
③由Zn、Cu和稀硫酸组成的原电池工作时,若Cu极生成0.1g H2,则电路通过电子0.1NA;
④1mol Cl2发生反应时,转移的电子数一定是2NA;
⑤在标准状况下,11.2L NO与11.2L O2混合后气体分子数为0.75NA;
⑥常温常压下,14g由乙烯和丙烯组成的混合气体所含的原子数为3NA;
⑦标准状况下,22.4L水中含分子数为NA;
⑧1mol C10H22分子中共价键总数为31NA;
⑨在由氧元素和氟元素组成的化合物二氟化氧(OF2)中,氧呈+2价,氟显-1价,由此可推知氟的非金属性比氧强;
⑩2mol HF溶于水配成的溶液中含F-离子数为2NA.
查看习题详情和答案>>
本题为选做题,包括A、B两题.选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题.若两题都作答,则以A题计分.
A.《化学与生活》
(1)食品和药品关系人的生存和健康.
①市场上销售的食盐品种很多.下列食盐中,所添加的元素不属于人体必需微量元素的是
A.加锌盐 B.加碘盐 C.加钙盐
②纤维素被称为“第七营养素”.食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质.从化学成分看,纤维素是一种
A.多糖 B.蛋白质 C.脂肪
③某同学感冒发烧,他可服用下列哪种药品进行治疗
A.麻黄碱 B.阿司匹林 C.抗酸药
(2)蛋白质是生命的基础,没有蛋白质就没有生命.请回答下列问题:
①油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和
②人体摄入的蛋白质在胃蛋白酶和胰蛋白酶的作用下,水解成
③维生素C是一种重要维生素,能防治坏血病.用淀粉溶液、碘水为试剂,验证维生素C具有还原性的实验操作和现象是
(3)材料是人类赖以生存和发展的重要物质基础.
①普通玻璃是生活中常用的硅酸盐材料,其主要成分是Na2SiO3、CaSiO3和
②通常使用的钢铁是铁和
③天然橡胶(生胶)是线型高分子,因高分子链上有双键易老化,工业上常将它与含硫物质作用转变成为体型的网状分子的
B.《有机化学》
(1)有机物含有的官能团不同,性质也有差异.
①1mol下列有机物可与2mol溴单质发生加成反应的是
A.乙烯 B.乙炔 C.乙烷
②下列有机物中,核磁共振氢谱只有一个吸收峰的是
A.苯 B.苯酚 C.苯甲酸
③下列有机物中,能发生银镜反应的是
A.乙酸乙酯 B.乙醇 C.葡萄糖
(2)分子式为C4H10O,属于醇的同分异构体有
 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式
 .
.
(3)科学家常采用将药物连接在高分子载体上,制成缓释长效药物.已知某种解热镇痛类药物,其结构简式如图甲,把它连接到高分子聚合物B上,形成缓释长效药物C如图乙.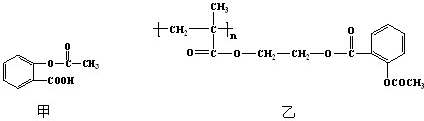
①分子聚合物B的结构简式为
 .
.
②A与B反应生成C的有机反应类型是
③A可水解成
 和
和
查看习题详情和答案>>
A.《化学与生活》
(1)食品和药品关系人的生存和健康.
①市场上销售的食盐品种很多.下列食盐中,所添加的元素不属于人体必需微量元素的是
C
C
(填字母).A.加锌盐 B.加碘盐 C.加钙盐
②纤维素被称为“第七营养素”.食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质.从化学成分看,纤维素是一种
A
A
(填字母).A.多糖 B.蛋白质 C.脂肪
③某同学感冒发烧,他可服用下列哪种药品进行治疗
B
B
(填字母).A.麻黄碱 B.阿司匹林 C.抗酸药
(2)蛋白质是生命的基础,没有蛋白质就没有生命.请回答下列问题:
①油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和
甘油
甘油
(写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料.②人体摄入的蛋白质在胃蛋白酶和胰蛋白酶的作用下,水解成
氨基酸
氨基酸
,被人体吸收后,重新结合成人体所需的蛋白质.人体内蛋白质也在不断分解,最后生成尿素排出体外.蛋白质在一定条件下能发生变性,从而失去生理活性.万一误服硫酸铜溶液,此时应立即作怎样的处理?服用牛奶、蛋清或蛋白质等富含蛋白质的食品
服用牛奶、蛋清或蛋白质等富含蛋白质的食品
.③维生素C是一种重要维生素,能防治坏血病.用淀粉溶液、碘水为试剂,验证维生素C具有还原性的实验操作和现象是
取少许淀粉溶液,加入数滴碘水呈蓝色,再加入维生素C,振荡后溶液蓝色褪去
取少许淀粉溶液,加入数滴碘水呈蓝色,再加入维生素C,振荡后溶液蓝色褪去
.(3)材料是人类赖以生存和发展的重要物质基础.
①普通玻璃是生活中常用的硅酸盐材料,其主要成分是Na2SiO3、CaSiO3和
SiO2
SiO2
(填化学式).生产普通玻璃时,石英和碳酸钠高温下反应的化学方程式为Na2CO3+SiO2
Na2SiO3+CO2↑
| ||
Na2CO3+SiO2
Na2SiO3+CO2↑
.
| ||
②通常使用的钢铁是铁和
碳
碳
的合金;为增强铁器件的抗腐蚀能力,常用一种“烤蓝”的方法处理铁器表面使铁器表面氧化生成一层致密的薄膜,其成分为Fe3O4
Fe3O4
(填化学式);当镀锌自行车钢圈镀层被损坏后,这时铁被腐蚀速度比锌慢
慢
(填“快”或“慢”).③天然橡胶(生胶)是线型高分子,因高分子链上有双键易老化,工业上常将它与含硫物质作用转变成为体型的网状分子的
硫化
硫化
橡胶.B.《有机化学》
(1)有机物含有的官能团不同,性质也有差异.
①1mol下列有机物可与2mol溴单质发生加成反应的是
B
B
(填字母).A.乙烯 B.乙炔 C.乙烷
②下列有机物中,核磁共振氢谱只有一个吸收峰的是
A
A
(填字母).A.苯 B.苯酚 C.苯甲酸
③下列有机物中,能发生银镜反应的是
C
C
(填字母).A.乙酸乙酯 B.乙醇 C.葡萄糖
(2)分子式为C4H10O,属于醇的同分异构体有
4
4
种,其中一种不能氧化成醛或酮,它的结构简式是



(3)科学家常采用将药物连接在高分子载体上,制成缓释长效药物.已知某种解热镇痛类药物,其结构简式如图甲,把它连接到高分子聚合物B上,形成缓释长效药物C如图乙.

①分子聚合物B的结构简式为


②A与B反应生成C的有机反应类型是
酯化反应
酯化反应
.③A可水解成


CH3COOH
CH3COOH
(写结构简式).