9.(16分)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:Na2S2O3在酸性溶液中不能稳定存在。
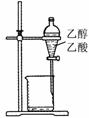
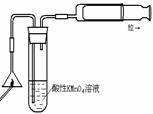
(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下。
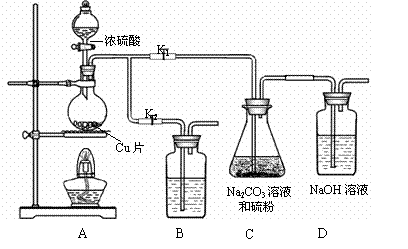
I.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
II.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
当C中溶液的pH接近7时即停止C中的反应,停止加热。
III.过滤C中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
① I中,圆底烧瓶中发生反应的化学方程式是 。
② II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 。
“停止C中的反应”的操作是 。
③ III中,“过滤”用到的玻璃仪器是(填仪器名称) 。
④ 装置B中盛放的试剂是(填化学式) 溶液,其作用是 。
(2)依据反应2S2O32-+I2=S4O62-+2I-,可用I2的标准溶液测定产品的纯度。取5.5 g 产品,配制成100 mL溶液。取10 mL溶液,以淀粉溶液为指示剂,用浓度为0.050 mol/L I2的标准溶液进行滴定,相关数据记录如下表所示。
|
编 号 |
1 |
2 |
3 |
4 |
|
溶液的体积/mL |
10.00 |
10.00 |
10.00 |
10.00 |
|
消耗I2标准溶液的体积/mL |
19.99 |
19.98 |
17.13 |
20.03 |
① 判断达到滴定终点的现象是 。
② Na2S2O3•5H2O在产品中的质量分数是(计算结果保留1位小数) 。
(Na2S2O3•5H2O的式量为248)
备注:本题根据北京市西城区2010抽样测试卷27题改编ww.k@s@5@ 高#考#资#源#网
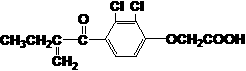
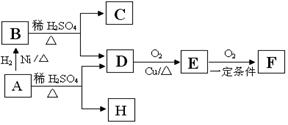 (2)A与M互为同分异构体,B无支链,B与羧酸和醇都能发生酯化反应,A在一定条件下能发生如下转化:
(2)A与M互为同分异构体,B无支链,B与羧酸和醇都能发生酯化反应,A在一定条件下能发生如下转化: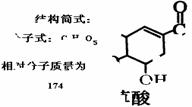
 N2(g)+2CO2(g)
N2(g)+2CO2(g) N2(g)+2CO2(g)的△H=___________。
N2(g)+2CO2(g)的△H=___________。
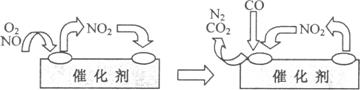
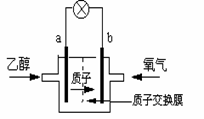
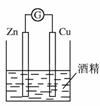
 电池总反应为:C2H5OH +3O2 2CO2 +3H2O,
电池总反应为:C2H5OH +3O2 2CO2 +3H2O,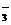 、Br-、Ba2+
、Br-、Ba2+