0 43238 43246 43252 43256 43262 43264 43268 43274 43276 43282 43288 43292 43294 43298 43304 43306 43312 43316 43318 43322 43324 43328 43330 43332 43333 43334 43336 43337 43338 43340 43342 43346 43348 43352 43354 43358 43364 43366 43372 43376 43378 43382 43388 43394 43396 43402 43406 43408 43414 43418 43424 43432 447348
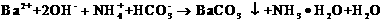
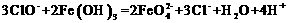
 Na2CO3+CO2↑+H2O高考资源
Na2CO3+CO2↑+H2O高考资源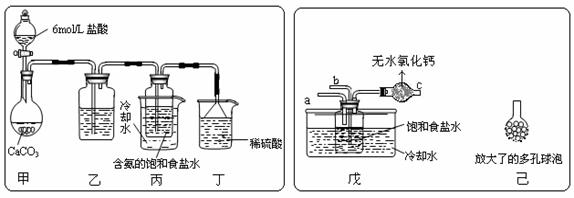 (Ⅱ)丁装置中稀硫酸的作用是
;
(Ⅱ)丁装置中稀硫酸的作用是
; 如右图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜,一段时间后停止通电,A池D极产生的气体在标准状况下为2.24 L。下列说法正确的是
如右图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜,一段时间后停止通电,A池D极产生的气体在标准状况下为2.24 L。下列说法正确的是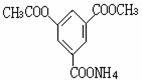 某有机物的结构简式为,下列叙述正确的是( )
某有机物的结构简式为,下列叙述正确的是( )