0 43220 43228 43234 43238 43244 43246 43250 43256 43258 43264 43270 43274 43276 43280 43286 43288 43294 43298 43300 43304 43306 43310 43312 43314 43315 43316 43318 43319 43320 43322 43324 43328 43330 43334 43336 43340 43346 43348 43354 43358 43360 43364 43370 43376 43378 43384 43388 43390 43396 43400 43406 43414 447348
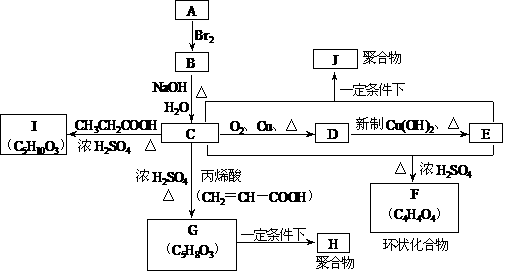
 德国化学家列培是乙炔高压化学的开拓者,他发现了一系列乙炔的高压反应(被称为列培反应),为有机合成工业作出了巨大的贡献。
德国化学家列培是乙炔高压化学的开拓者,他发现了一系列乙炔的高压反应(被称为列培反应),为有机合成工业作出了巨大的贡献。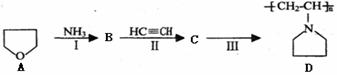 R2NH+HC≡CH→R2NCH =CH2等
R2NH+HC≡CH→R2NCH =CH2等