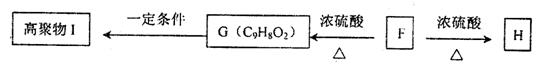22、(10分)A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
|
阳离子 |
Na+、Al3+、Ba2+、NH4+ |
|
阴离子 |
Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
① A、D溶液呈碱性,B呈酸性,C呈中性
② A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③ A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝
回答下列问题:
(1)A的化学式是 ,用电子式表示C的形成过程: 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大
到小的顺序是:
(3)写出③的离子方程式
(4)简述D溶液呈碱性的理由
21、(10分)下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
|
元素 |
有关信息 |
|
A |
元素主要化合价为 -2,原子半径为0.074 n
m |
|
B |
所在主族序数与所在周期序数之差为4 |
|
C |
原子半径为0.102 n m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
|
D |
最高价氧化物的水化物,能按1∶1电离出电子数相等的阴、阳离子 |
|
E |
原子半径为0.075 n m,最高价氧化物的水化物与其氢化物组成一种盐X |
(1)画出B的离子结构示意图 ;写出D元素最高价氧化物的水化物电子式 。
(2)盐X水溶液显 (填“酸”“碱”“中”)性,用离子方程式解释其原因 ;(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为 ;
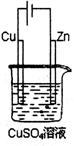 (4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20-30%的KOH溶液。该燃料电池放电时,正极的电极反应式是 。
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20-30%的KOH溶液。该燃料电池放电时,正极的电极反应式是 。
(5)如右图是一个电解过程示意图。假设使用Y-空气燃料电池作为本过程的
电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空
气(设空气中氧气的体积含量为20%) L。
 下列化学用语使用正确的是 ( )
下列化学用语使用正确的是 ( )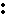
 A.质量数为37的氯原子:17
37Cl B.Ca2+的结构示意图为:
A.质量数为37的氯原子:17
37Cl B.Ca2+的结构示意图为: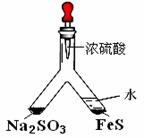 利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。
利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。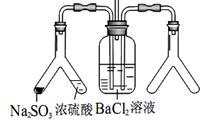 (2)实验目的:探究 SO2与BaCl2反应产生沉淀的条件。
(2)实验目的:探究 SO2与BaCl2反应产生沉淀的条件。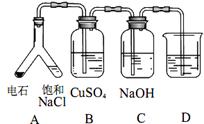 (3)实验目的:探究电石气中的成分。
(3)实验目的:探究电石气中的成分。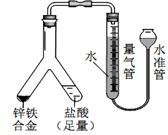 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液
①读取量气管中数据时,若发现水准管中的液面低于量气管中液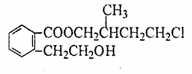 ,回答下列问题:
,回答下列问题: