9.(改编)(14分) 联合国气候变化大会2009年12月7日在丹麦首都哥本哈根拉开帷幕,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。298.15K时,CO2、H2、与CH3OH、H2O的平均能量与合成甲醇反应的活化能的曲线图如下所示ww.k@s@5@ 高#考#资#源#网,据图回答问题:
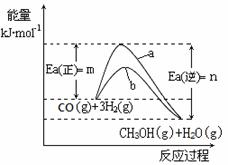
①写出合成甲醇反应的热化学方程式_____________________________________;
②在图中曲线_____(填“a”或“b”)表示加入催化剂的能量变化曲线,催化剂能加快反应速率的原理是____________________________________________________;
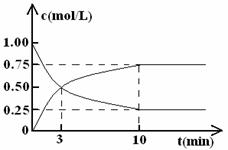 ③在体积为l L的密闭容器中,充入lmol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
③在体积为l L的密闭容器中,充入lmol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡,甲醇的平均反应速率v(CH3OH)= ;
该反应的平衡常数k= 。ww.k@s@5@ 高#考#资#源#网
(2)乙醇是重要的化工产品和液体燃料,同样可以利用CO2反应制取乙醇:
 2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
在一定压强下,测得反应的实验数据如下表。分析表中数据回答下列问题:
 |
500 |
600 |
700 |
800 |
|
1.5 |
45 |
33 |
20 |
12 |
|
2.0 |
60 |
43 |
28 |
15 |
|
3.0 |
83 |
62 |
37 |
22 |
①温度升高,K值 (填“增大”、“减小”、或“不变”)。
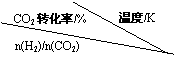
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”、或“不变”),对生成乙醇 (填“有利”或“不利”)。
 ③在右图的坐标系中作图说明压强变化对反应①的化学平衡的
③在右图的坐标系中作图说明压强变化对反应①的化学平衡的
影响。并对图中横坐标、纵坐标的含义作必要的标注。
11.(根据2011年富阳中学高考预测卷第17题改编)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:
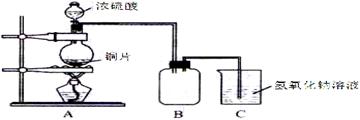
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整。
(2)实验中他们取6.4g 铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:____________________________________;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是____________________;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:________(填写编号)。
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度_______(填“能”或“不能”),其理由是_________________________________________________。ww.k@s@5@ 高#考#资#源#网
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首。汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等。有人设计利用反应2NO + 2CO  N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间/h |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/mol·L-1 |
1.00×10-3 |
4.5×10-4 |
2.5×10-4 |
1.5×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)/mol·L-1 |
3.6×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
在上述条件下反应能够自发进行,则反应的 ______
0(“>”、“<”、“=”)。前2h内的平均反应速率v(N2)=
_____________,在该温度下,反应的平衡常数K= ____________ 。据此你认为将该反应从理论转化为现实的最重要的研究方向是___________________
______
0(“>”、“<”、“=”)。前2h内的平均反应速率v(N2)=
_____________,在该温度下,反应的平衡常数K= ____________ 。据此你认为将该反应从理论转化为现实的最重要的研究方向是___________________
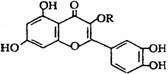 B.该物质中最多有7个碳原子共平面
B.该物质中最多有7个碳原子共平面