26.已知某重金属化合物能催化H2O2的分解。下图是氨的催化氧化的实验装置,试管中加入适量浓氨水并滴入1ml 2%AgNO3(aq),溶液仍然澄清,B为胶头滴管,吸有25%的H2O2(aq),A是气球,C中装有铂石棉催化剂。点燃酒精灯一段时间后,将B中的H2O2溶液慢慢地滴入试管,试管中逸出大量气体使气球鼓起。回答下列问题:
(1)得到的澄清溶液名称为________________,试管中逸出的气体是 。
(2)C中发生化学反应后,就可以停止加热,原因是: 。
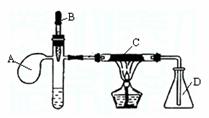 (3)D中的现象是
。
(3)D中的现象是
。
(4)A的作用是 。
(5)本实验还可以改用其他药品,例如在试管中加
,胶头滴管预先吸入 。(写物质名称)
(6)此实验装置的缺点是 。
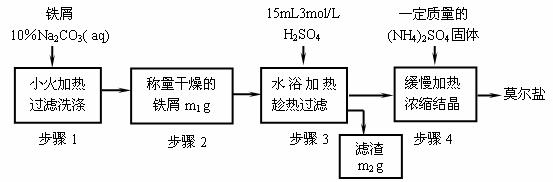
27.硫酸亚铁铵的化学式为(NH4)2SO4•FeSO4•6H2O,商品名为莫尔盐,可由硫酸亚铁与硫酸铵反应生成。一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了。三种盐的溶解度(单位为g/100g水)如下表:
|
温度/℃ |
10 |
20 |
30 |
|
(NH4)2SO4 |
73.0 |
75.4 |
78.0 |
|
FeSO4·7H2O |
20.0 |
26.5 |
32.9 |
|
(NH4)2SO4•FeSO4 |
17.2 |
21.6 |
28.1 |
25. 反应① Fe(s)+CO2(g) FeO(s)+CO(g)
+akJ;
反应① Fe(s)+CO2(g) FeO(s)+CO(g)
+akJ;
 反应② CO(g)+1/2O2(g) CO2(g)
+bkJ
反应② CO(g)+1/2O2(g) CO2(g)
+bkJ
测得在不同温度下,反应①的平衡常数K值随温度的变化如下:
|
温度/℃ |
500 |
700 |
900 |
|
K |
1.00 |
1.47 |
2.40 |
(1)反应①的化学平衡常数表达式为 ,a 0(填“大于”、“小于”或“等于”)。 在500℃2L密闭容器中进行反应①,CO2起始量为4mol,其转化率为50%,则CO的平衡浓度为 。
(2)700℃反应①达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
(填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到900℃ D.使用合适的催化剂
(3)下列图像符合反应①的是
(填序号)(图中v是速率、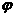 为混合物中CO含量,T为温度且T1>T2)
为混合物中CO含量,T为温度且T1>T2) 。
。
 (4)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)+Q 的Q=
。
(4)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)+Q 的Q=
。
24.下面是元素周期表的前三周期。请用相应的化学用语回答下列问题:
|
a |
|
|
|
|
|
|
|
|
b |
|
|
c |
d |
e |
f |
|
|
g |
|
h |
|
|
|
|
|
(1)写出由e形成的两种阴离子的符号,它们带有相同的电荷数:____________、____________;
(2)h的单质能与g元素的最高价氧化物对应水化物的溶液反应,请写出该反应的化学方程式____________________________________
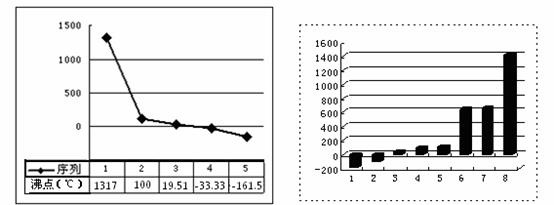
(注:序列与b、c、d、e、f 并不一一对应)
(3)上左图表示的是b、c、d、e、f的氢化物的沸点(℃)。序列 “5”的氢化物是由______键构成的______分子(均填写“极性”或“非极性”)。由c和 e 组成的可灭火的物质的电子式是____________ 。
(4)上右图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则柱形“8”熔点最高的原因是_____________________ 。
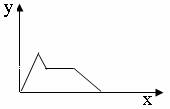
21.下列坐标图所表示的量的关系正确的是 B
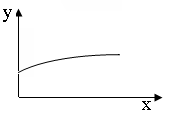
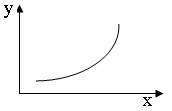
|
|

|
|||
|
|||
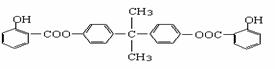 利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,已知G不能发生银镜反应,BAD结构简式为:
利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,已知G不能发生银镜反应,BAD结构简式为: 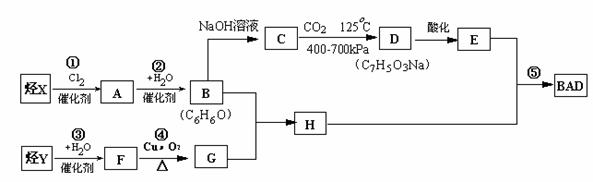
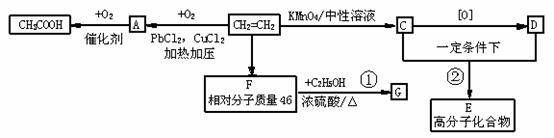
 ____Fe(OH)3 + ____ClO- + ____OH- --____FeO + ____Cl-+ ____H2O
____Fe(OH)3 + ____ClO- + ____OH- --____FeO + ____Cl-+ ____H2O