27.某厂用蛭石(主要成份为:MgO、Fe2O3、A12O3、SiO2)作原料生产A12O3与Fe(OH)3。
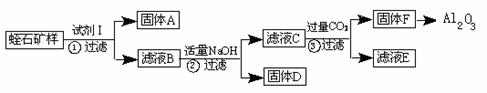 Ⅰ.工艺流程如下(只有固体A和F为纯净物):
Ⅰ.工艺流程如下(只有固体A和F为纯净物):
Ⅱ.查阅资料:某些阳离子浓度为0.1mol/L时,氢氧化物沉淀时的pH为:
|
氢氧化物 |
Fe(OH)3 |
Mg(OH)2 |
Al(OH)3 |
|
开始沉淀时的pH |
2.3 |
10.4 |
4.0 |
|
完全沉淀时的pH |
3.7 |
12.4 |
5.2 |
注:Al(OH)3 pH=7.8时开始溶解,10.8时完全溶解。
请回答以下问题:
(1)写出下列物质化学式:试剂I______________,F ;
(2)步骤②B生成C的离子方程式: ;
(3)要使固体D杂质尽量少,步聚②调节溶液的pH合理的是 ;
A.12.4~13 B.10.8 C.3.7~5.2
(4)滤液E中存在较多的阴离子是_____________,滤液E中加入过量的NaOH溶液,充分沉淀后,检验上层清液中金属阳离子的操作步骤是________________________;
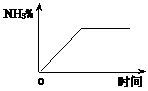 (5)固体D可用来生产合成氨的表面催化剂。右图表示无催化剂时,某合成氨的NH
(5)固体D可用来生产合成氨的表面催化剂。右图表示无催化剂时,某合成氨的NH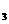 的百分含量随时间变化曲线,请在图上用虚线画出该反应有催化剂时的曲线。
的百分含量随时间变化曲线,请在图上用虚线画出该反应有催化剂时的曲线。
26.现有一瓶已久置的Na2SO3固体,为了研究其组成,同学们进行了如下探究:
可选用试剂:浓H2SO4、浓HNO3、10%盐酸、0.1mol/LH2SO4、0.1mol/L HNO3、0.1mol/LBaCl2、0.1mol/LBa(NO3)2、3%H2O2、10%NaOH溶液、蒸馏水、品红溶液;
仪器自选。
(1)提出假设
假设一:固体全部是Na2SO3;
假设二:固体全部是Na2SO4;
假设三: ;
(2)设计实验方案(略);
(3)同学们经充分讨论后选择D装置进行实验:原因是:_____________________;
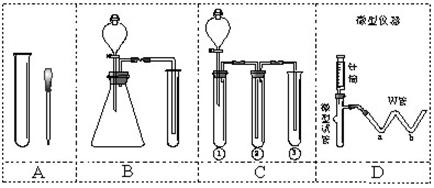
(4)请完成下表:
|
实验步骤 |
预期现象和结论 |
|
步骤1:取适量固体样品于微型试管中;在W管a处滴入 、b处滴入10%NaOH溶液;用胶管将W管与微型试管连接好。 |
|
|
步骤2:用针筒吸入10%盐酸,将针头穿过微型试管的胶塞,向固体注入过量的盐酸。 |
若无气泡放出、且品红不褪色,则: : 若 ,则假设一或假设三成立。 |
|
步骤3:拨出针筒,吸入蒸馏水洗净;再吸入适量0.1mol/LBaCl2溶液注入________中。 |
若假设一成立,则试管中产生无白色沉淀,a处品红溶液褪色。 若假设二成立,则__________________。 若假设三成立,则__________________。 |
23.四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
单质为银白色固体、导电性强。其在空气中燃烧生成淡黄色固体。 |
+3价阳离子的核外电子排布与氖原子相同。 |
单质常温、常压下是气体,原子的L层有一个未成对的p电子。 |
原子核外s电子数等于p电子数。它存在同素异形体。 |
(1)B元素在周期表中的位置 ,写出A原子的电子排布式 ;
(2)写出A与D形成化合物的电子式 ;
A与D形成的化合物溶于水后,溶液的pH 7(填“大于”、“等于”或“小于”)。
(3)写出C单质与水反应的化学方程式: ;
(4)A、B两元素金属性较强的是(写元素符号) ,写出证明这一结论的一个实验事实 ;
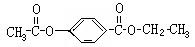
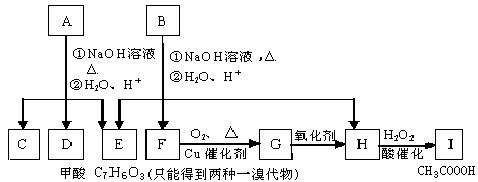 A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。
A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。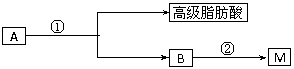

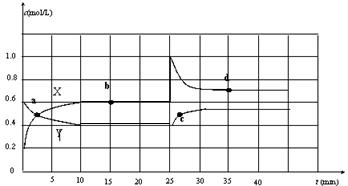 现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图。已知:2NO2(g) N2O4(g)+Q。
现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图。已知:2NO2(g) N2O4(g)+Q。 (2)将氧化剂与还原剂及配平好的系数填入下列空格中,并标出电子转移的方向和数目:
(2)将氧化剂与还原剂及配平好的系数填入下列空格中,并标出电子转移的方向和数目: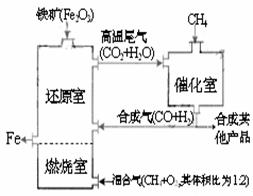 竖炉炼铁工艺流程如图,使天然气发生部
竖炉炼铁工艺流程如图,使天然气发生部 CO(g)+3H2(g)-216kJ
CO(g)+3H2(g)-216kJ