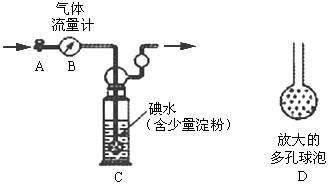
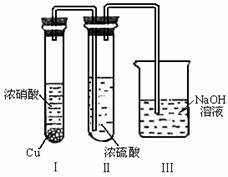
0 41746 41754 41760 41764 41770 41772 41776 41782 41784 41790 41796 41800 41802 41806 41812 41814 41820 41824 41826 41830 41832 41836 41838 41840 41841 41842 41844 41845 41846 41848 41850 41854 41856 41860 41862 41866 41872 41874 41880 41884 41886 41890 41896 41902 41904 41910 41914 41916 41922 41926 41932 41940 447348
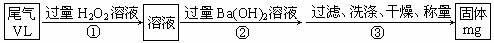
 FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
 (2)D与等物质的量醋酸反应所得溶液的PH__________7,(填“>”,“<”,“=”)。原因是(用文字和离子方程式说明)
(2)D与等物质的量醋酸反应所得溶液的PH__________7,(填“>”,“<”,“=”)。原因是(用文字和离子方程式说明)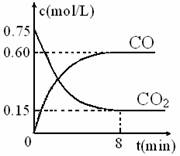
 反应mA(s)+nB(g)
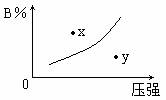
反应mA(s)+nB(g)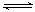 pC(g) △H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
pC(g) △H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( ) 4Na+O2↑+2H2O;后来,盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:
4Na+O2↑+2H2O;后来,盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为: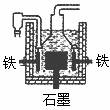 3Fe+4NaOH
3Fe+4NaOH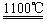 4Na↑+2H2↑+Fe3O4。下列有关说法正确的是( )
4Na↑+2H2↑+Fe3O4。下列有关说法正确的是( ) 2OH-
+ H2↑+ Cl2↑
2OH-
+ H2↑+ Cl2↑