19.(12分)
 本题包括A、B两小题,分别对应“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,将按A题评分。
本题包括A、B两小题,分别对应“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,将按A题评分。
A. 氢气是重要而洁净的能源,
B. 要利用氢气作能源,必须安
C. 全有效地储存氢气。
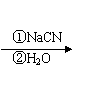
(1)某种铜镍合金材料有较大的储氢容量,
其晶体结构如图所示。这种合金中La与Ni
的原子个数比为 ;其中基态Ni
原子的核外电子排布式为 。
(2)氢元素可与其他四种短周期元素a、b、c、d、e、f、g等七种微粒,它们都有10个电子,其填结构特点如下表:
|
微粒 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
双核 |
双核 |
三核 |
四核 |
四核 |
五核 |
五核 |
|
所带单位电荷 |
0 |
-1 |
0 |
0 |
+1 |
|
+1 |
①与c互为等电子体的一种阴离子是 (填化学式);
②微粒中中心原子的杂化方式为 杂化。
③比较相同条件下a与f在水中的溶解度:a f(填“>”、“=”或“<”)
 ④Ni2+可与d形成配位数为6的配离子,该配离子的化学式为 。
④Ni2+可与d形成配位数为6的配离子,该配离子的化学式为 。
B.实验室通常以环已醇为原料在浓硫酸作用下脱水来制备环己烯。
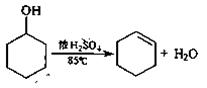
实验步骤下:
①在25mL干燥的圆底烧瓶中加入10g环己醇和0.5mL 98%浓硫酸,充分振荡。
②向烧瓶中放入2~3粒沸石,安装分馏装置,接收瓶用冰水冷却。
③小心加热,控制加热速度使温度不超过90℃,直到瓶底剩余少量残渣并出现白雾时停止加热。(已知:环己烯,沸点82.98℃;环己烯-10%水,沸点70.8℃;环己醇-80%水,沸点97.8℃:环己醇-30.5%环己烯,沸点64.9℃)
④向馏出液中加约1g精盐使其达饱和,然后加入2mL饱和碳酸钠水溶液,充分振荡。
⑤……
⑥有机层倒入干燥的小锥形瓶中,加入1~2g无水氯化钙干燥。待溶液清亮透明后过滤。
⑦将滤液移入圆底烧瓶中,加入2~3粒沸石,蒸馏。收集80~85℃馏分,称重约7.4g。
⑧计算。
请回答下列问题:
(1)步骤①中,加入10g环已醇和0.5mL 98%浓硫酸的顺序是 ;
(2)步骤③中,为便干控制加热温度,应该采取的加热方法是 ;
(3)步骤④中,向馏出液中加约1g精盐使其达饱和的目的是 ;
(4)步骤⑤的操作是 ;
(5)步骤⑧计算得到的环己烯的产率为 ;分析实制得的环己烯质量低于理论产量可能的原因是 。

 FeO(s)+CO(g) Fe(s)+CO2(g) △H=-1kJ/mol。
FeO(s)+CO(g) Fe(s)+CO2(g) △H=-1kJ/mol。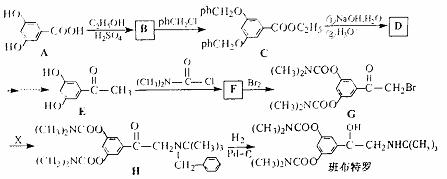
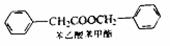 (5)苯乙酸苯甲酯可用作花香型日用香精。请设计合理
(5)苯乙酸苯甲酯可用作花香型日用香精。请设计合理