7.(14分)有A、B、C三种短周期元素在周期表中相对位置如下:
|
A |
|
|
|
|
|
|
B |
C |
(1)A与B、A与C形成的液体化合物是常见的重要溶剂,则A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:_________>_________>___________(用化学式表示)。
(2)B、C两种元素对应单质分别为X、Y。标准状况下,X的密度为3.17g/L。Z是一种化合物,焰色反应呈紫(透过钴玻璃), 0.1mol/L Z水溶液pH=13 。X、Y、Z有如图转化关系:
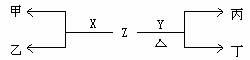
① 写出X与Z反应的离子方程式:______________________________________
② 已知丙能与稀硫酸反应生成使品红褪色的气体。
丁的化学式________________,
丁的水溶液pH>7原因______________________________________(用离子方程表示)
将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4(aq)(硫酸酸化)中,恰好褪色。写出反应的离子方程式__________________________________________
③ 石墨和铁做电极,用隔膜电解槽(不考虑产物之间相互反应)电解甲的溶液,阳极产生气体X,铁做________极,写出电解甲溶液的离子方程式__________________________
④ 实验室用含X元素的一种化合物E制取O2 ,工业上用无隔膜电解槽(考虑产物之间相互反应)电解甲的溶液生产化合物E,假设电解时电解槽进液口溶液中甲浓度为2mol/L,出液口溶液中甲浓度为1.6mol/L(进出口流量相同)则出液口溶液E浓度是____________mol/L 。
4.下述实验中不能达到预期实验目的的是:
|
编号 |
实验内容 |
实验目的 |
|
A |
C2H5Cl和NaOH溶液混合后振荡再加入AgNO3溶液 |
检验C2H5Cl中的Cl元素 |
|
B |
向沸腾的水中滴加FeCl3饱和溶液,继续煮沸至溶液呈红褐色为止 |
制备Fe(OH)3胶体 |
|
C |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
|
D |
室温下,用pH计测定浓度为0.1mol/LNaClO溶液CH3COONa溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
8.
根据生产流程,回答下列问题:
(1) 写出B的结构简式 , C8H602Br2的结构简式
(2)写出反应①的化学方程式
(3)反应②④⑥⑧⑩中属于取代反应的是 ,设计反应③④⑤的目的是
(4) E与乙二醇发生聚合反应的化学方程式
29(18分〉
硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀
硫酸的混合物中,加热使之反应完全(装置如题29图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶
体中结晶水的含量
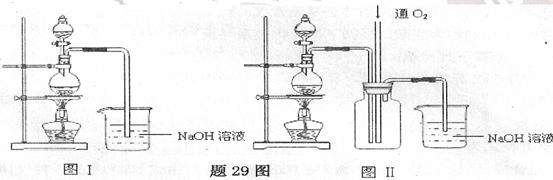
(1)怎样检查图I装置的气密性
(2)图I中分液漏斗内装的液体是
(3)图Ⅱ是图I的改进装置,与图I相比,图Ⅱ装置的明显优点是
(可不答满).
(4)课外兴趣小组同学在测定胆矶(CuS04 • XH2O)晶体中结晶水的含量时.测得有关数据如下表:
|
加热前质量 |
加热后质量 |
- |
|
|
m1(容器〉 |
m2〈容器+晶体〉 |
m3(容器+无水CuS04) |
|
|
5.4g |
7.9g |
6.8g |
|
①为完成测定,题29图Ⅲ中还缺少的仪器名称是
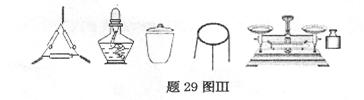
②判断样品己恒重的方法是
③测定所得胆矶(CuS01'xffiO)中结晶水含量的实验中,称量操作至少进行 次.
④课外兴趣小组的测定结果x值(与CuS04 • 5H20相比) (填"偏高"、"偏低"、"不变”),可能的
原因是 .(填字母序号〉
a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却 d.胆矾晶体部分风化
 Ca2+ (aq) + 2OH-(aq) 下列有关该平衡体系的说法正确的是:
Ca2+ (aq) + 2OH-(aq) 下列有关该平衡体系的说法正确的是: