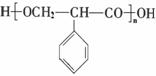
28.(14分)近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知 ① 2 CH4 (g) + 3O2 (g) = 2 CO (g) + 4 H2O(l) △H1 = -1214.6 KJ/mol
② 2 CO (g) + O2(g) = 2 CO2 (g) ΔH2 = -566 kJ/mol
则反应CH4(g) + 2 O2 (g) = CO2 (g) + 2 H2O (l) 的△H = 。
(2)将两个石墨电极插人KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是:CH4 + 10 OH―― 8e-= CO32-+ 7 H2O;通入O2的一极,其电极反应式是 。
(3)若用石墨做电极电解500 ml饱和食盐水,写出电解反应的离子方程式为: ;电解一段时间后两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)。停止通电,假设反应前后溶液体积不变,则所得溶液的pH= 。
 (4)将不同量的CO (g) 和H2O
(g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
(4)将不同量的CO (g) 和H2O
(g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
CO (g) + H2O (g) CO2 (g) + H2 (g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
|
H2O |
CO |
CO2 |
CO |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
① 实验1中以υ(H2) 表示的反应速率为 。
② 实验2中的平衡常数是 (计算结果保留两位小数)。
③ 该反应的正反应为 (填“吸”或“放”)热反应。
④ 若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),
则a、b应满足的关系是 (用含a、b的数学式表示)。
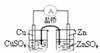
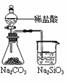
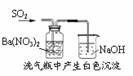
12.下列实验对应的结论正确的是
|
实验 |
 |
 |
 |
 |
|
结论 |
能组成 Zn、Cu原电池 |
能证明非金属性 Cl>C>Si |
白色沉淀 为BaSO3 |
说明反应 2NO2  N2O4
△H>0 N2O4
△H>0(无色) |
|
选项 |
A |
B |
C |
D |
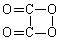 D. 反应①属于酯水解反应
D. 反应①属于酯水解反应 H2↑ + Cl2↑ + 2OH-(2分)
H2↑ + Cl2↑ + 2OH-(2分) NH3·H2O
NH3·H2O

 (3)① 3CuO + 2NH3
3Cu + N2 + 3H2O (2分)
(3)① 3CuO + 2NH3
3Cu + N2 + 3H2O (2分) 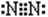 (13分)(1)第二周期 第ⅣA族 (2分)
(2分)
(13分)(1)第二周期 第ⅣA族 (2分)
(2分)
 (5)CH2Cl2、CHCl3、CCl4
(2分)
(5)CH2Cl2、CHCl3、CCl4
(2分) 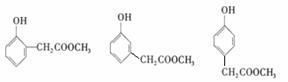 (2)
(2) 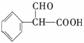
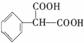
 ③
③ 
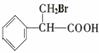
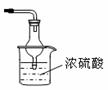
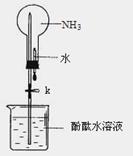 (16分)氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:
(16分)氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:
 (4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ Cu + Cu2+)。
(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ Cu + Cu2+)。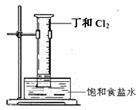 (4)乙和B、D、E组成的化合物丙,它们的水溶液pH均为12时,两溶液中由水电离出的c(OH-),乙 :丙=
。
(4)乙和B、D、E组成的化合物丙,它们的水溶液pH均为12时,两溶液中由水电离出的c(OH-),乙 :丙=
。 (1)以下推测正确的是 (填字母)。
(1)以下推测正确的是 (填字母)。