1.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是
( )
|
|
A |
B |
C |
D |
|
X |
FeCl2溶液 |
FeCl3溶液 |
Fe |
Na2SO4溶液 |
|
Y |
FeCl3 |
CuCl2 |
Al |
Na2CO3 |
|
Z |
Cl2 |
Fe |
NaOH溶液 |
BaCl2溶液 |
[答案] C
20. (10分)某兴趣小组设计出如右图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
(10分)某兴趣小组设计出如右图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
(1)实验前,关闭活寒b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是______________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL的浓硝酸,c中反应的化学方程式是__________________。
再由a向c中加2 mL蒸馏水,c中的实验现象是___________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是________,理由是________________________________________________________________________。
|
方案 |
反应物 |
|
甲 |
Cu、浓HNO3 |
|
乙 |
Cu、稀HNO3 |
|
丙 |
Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2。操作步骤为__________,
实验现象为___________________________________,
但此实验的不足之处是_____________________________________。
[解析] (1)连接好一整套装置,关闭分液漏斗活塞,把出气导管液封,加热发生装置,显然是检验装置气密性。
(2)铜片与2 mL浓硝酸反应的化学方程式Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,再加入2 mL蒸馏水,硝酸浓度变稀,降低了反应物浓度使反应减慢,同时产物气体由NO2变NO,故装置中气体颜色变浅。
(3)从题表中制取硝酸铜的三种方案可以看出丙方案消耗反应物硝酸少(只起酸性作用)且不产生污染性气体NO、NO2等显然是体现绿色化学的最佳方案。
(4)要证明氧化性KMnO4>Cl2>Br2可以通过2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O、2KBr+Cl2===2KCl+Br2两个氧化还原反应证明之。具体的操作步骤可以是向d中加KBr(或NaBr),c中加入KMnO4固体,由a向c中加入浓盐酸;c中有黄绿色气体产生,d中溶液会变为黄棕色甚至红棕色,但气体和溶液反应,Cl2不一定完全被吸收,故还需要尾气吸收装置。
[答案] (1)检查装置气密性
(2)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 反应变缓,气体颜色变浅
(3)丙 耗酸量最少,无污染
(4)向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸 c中有黄绿色气体产生,d中溶液变为黄棕色 没有处理尾气
19.(11分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是______________________。反应完毕经冷却后,②的试管中有大量晶体析出。下图所示中符合该晶体溶解度曲线的是________(填写编号字母);从②的试管中分离出该晶体的方法是________(填写实验操作名称)。

(3)本实验中制取次氯酸钠的离子方程式是________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为________色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
|
|
然后溶液从无色逐渐变为________色 |
|
[解析] (1)浓盐酸属液体试剂,应通过分液漏斗逐滴加入;除Cl2中的HCl,应防止Cl2消耗,排除A、D项,又需吸收HCl,排除C项。
(2)①从题目条件上看:浓度不同,KOH溶液是30%,NaOH溶液是8%;温度不同,KOH溶液需水浴加热,而NaOH溶液却用冰水浴冷却。②“反应完毕经冷却后,②的试管中有大量晶体析出”指明该晶体的溶解度随温度降低而降低,则在“溶解度-温度”图象中,应为增函数曲线。③晶体与液体分离的方法应采用过滤操作。
(3)由氯气与氢氧化钠反应生成次氯酸钠的化学方程式Cl2+2NaOH===NaCl+NaClO+H2O,改写即可。
(4)①“H+使石蕊变色”,溶液呈酸性石蕊应变红。
②石蕊属有色有机物,褪色应考虑漂白作用,是Cl2与水产生的HClO作用的结果。
③持续通入Cl2,会因Cl2溶于水中而使溶液显黄绿色。
[答案] (1)分液漏斗 B
(2)碱溶液(或反应物)的浓度不同,反应温度不同 M 过滤
(3)Cl2+2OH-===ClO-+Cl-+H2O
(4)
|
红 |
|
|
|
氯气与水反应生成的HClO将石蕊氧化为无色物质 |
|
黄绿 |
继续通入的氯气溶于水使溶液呈黄绿色 |

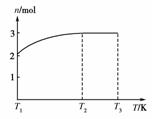 (4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如右图所示。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如右图所示。