网址:http://m.1010jiajiao.com/timu3_id_87646[举报]
 (2008?北京)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.
(2008?北京)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.已知:X+Y
| △ |
(1)Y的电子式是


(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是
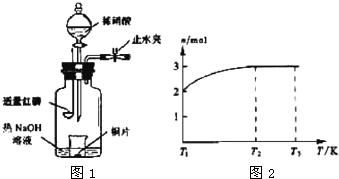
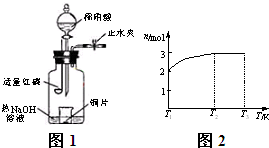
(3)用图1所示装置制备NO并验证其还原性.有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中.
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞.
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸.
①步骤c后还缺少的一步主要操作是
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是
③步骤c滴入稀硝酸后烧杯中的现象是
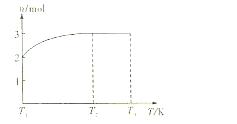
(4)一定温度下,将1mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色.温度由T1继续升高到T2的过程中,气体逐渐变为无色.若保持T2,增大压强,气体逐渐变为红棕色.气体的物质的量n随温度T变化的关系如图2所示.
①温度在T1-T2之间,反应的化学方程式是
②温度在T2-T3之间,气体的平均相对分子质量是(保留1位小数)
 X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成.X有5个原子核.通常状况下,W为无色液体.已知:X+Y
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成.X有5个原子核.通常状况下,W为无色液体.已知:X+Y
| ||
(1)Y的电子式是
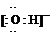
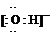
(2)液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是
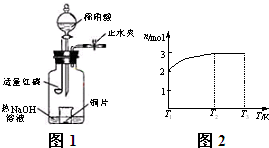
(3)用如图所1示装置制备NO并验证其还原性.有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中.
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞.
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸.步骤c后还缺少的一步主要操作是
(4)一定温度下,将1mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色.温度由T1继续升高到T2的过程中,气体逐渐变为无色.若保持T2,增大压强,气体逐渐变为红棕色.气体的物质的量n随温度T变化的关系如图2所示.温度在T1~T2之间,反应的化学方程式是
| ||
(1)Y的电子式是 .
(2)液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是 .
(3)用如图所1示装置制备NO并验证其还原性.有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中.
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞.
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸.步骤c后还缺少的一步主要操作是 .
(4)一定温度下,将1mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色.温度由T1继续升高到T2的过程中,气体逐渐变为无色.若保持T2,增大压强,气体逐渐变为红棕色.气体的物质的量n随温度T变化的关系如图2所示.温度在T1~T2之间,反应的化学方程式是 .
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y![]() Z+W
Z+W
(1)Y的电子式是_________________________。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_________________________________。
 (3)用图示装置制备NO并验证其还原性。有下列主要操作:
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是_______________________________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 ____________________________________________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是______________________________________
______________________________________________________________________。
反应的离子方程式是____________________________________________________。
 (4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
①温度在T1-T2之间,反应的化学方程式是_________________________。
②温度在T2-T3之间,气体的平均相对分子质量是(保留1位小数)______________。
查看习题详情和答案>>(12分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y Z+W
Z+W
(1)Z的空间构型为 。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是 。
(3)1mol气态Z与O2反应生成液态W和一种由两种元素组成的气体物质,放出的热量为QkJ,写出该反应的热化学方程式: 。
(4)一定温度下,将1mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
①温度在T1—T2之间,反应的化学方程式是: 。
②温度在T2—T3之间,气体的平均相对分子质量是(保留1位小数) 。
③若将实验所得的平衡混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气 L。(设空气组成为:N2与O2,体积比4:1)
查看习题详情和答案>>