摘要:16. 海水是巨大的资源宝库.在海水淡化及综合利用方面.天津市位居全国前列.从海水中提取食盐和溴的过程如下: (1)请列举海水淡化的两种方法: . . (2)将NaCl溶液进行电解.在电解槽中可直接得到的产品有H2. . 或H2. . (3)步骤Ⅰ中已获得Br2.步骤Ⅱ中又将Br2还原为Br-.其目的为 . (4)步骤Ⅱ用SO2水溶液吸收Br2.吸收率可达95%.有关反应的离子方程式为 . 由此反应可知.除环境保护外.在工业生产中应解决的主要问题是 . (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法.查阅了有关资料:Br2的沸点为59 ℃.微溶于水.有毒性和强腐蚀性.他们参观生产过程后.绘制了如下装置简图: 请你参与分析讨论: ①图中仪器B的名称: . ②整套实验装置中仪器连接均不能用橡胶塞和橡胶管.其原因为 . ③实验装置气密性良好.要达到提纯溴的目的.操作中如何控制关键条件: . ④C中液体产物颜色为 .为除去该产物中仍残留的少量Cl2.可向其中加入NaBr溶液.充分反应后.再进行的分离操作是 . [解析] (2)电解NaCl溶液:2NaCl+2H2OH2↑+Cl2↑+2NaOH.由以上反应生成的Cl2和NaOH进一步反应:Cl2+2NaOH===NaCl+NaClO+H2O.也可得到H2和NaClO. (3)步骤Ⅰ中获得低浓度Br2溶液.再经过步骤Ⅱ.Ⅲ可富集溴元素. (4)SO2与Br2发生氧化还原反应:SO2+Br2+2H2O===H2SO4+2HBr.产物是两种强酸.故在工业生产中要注意强酸对设备的严重腐蚀. (5)由已知信息Br2的强腐蚀性可得出Br2腐蚀橡胶.故装置中不能用橡胶塞和橡胶管.再由Br2的沸点为59 ℃可知用该套装置提纯溴关键要控制温度计b的温度.收集59 ℃时的馏分.C中收集到的是深红棕色的液溴.要除去该产物中残留的少量Cl2.可向其中加入NaBr充分反应后.利用Br2易溶于CCl4的性质进行分液来分离.或利用Br2易挥发的特点用蒸馏法分离. [答案] (1)蒸馏法.电渗析法.离子交换法及其他合理答案中的任意两种 (2)Cl2 NaOH NaClO Br2+SO2+2H2O===4H++SO42-+2Br- 强酸对设备的严重腐蚀 (5)①冷凝管 ②Br2腐蚀橡胶 ③控制温度计b的温度.并收集59 ℃时的馏分 ④深红棕色 分液
网址:http://m.1010jiajiao.com/timu3_id_86811[举报]
海水是巨大的资源宝库,可以进行综合利用.从海水中提取食盐和溴的过程如下:

(1)请写出一种海水淡化的方法: .
(2)步骤Ⅰ获得Br2 的离子方程式为 ;
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的.其反应方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是 (填化学式).若反应中生成 2mol HBr,则消耗 mol SO2.
(4)根据上述反应判断 SO2、Cl2、Br2 三种物质氧化性由强到弱的顺序是 .
查看习题详情和答案>>

(1)请写出一种海水淡化的方法:
(2)步骤Ⅰ获得Br2 的离子方程式为
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的.其反应方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是
(4)根据上述反应判断 SO2、Cl2、Br2 三种物质氧化性由强到弱的顺序是
海水是巨大的资源宝库,下列说法正确的是( )
| A、碘元素又称“海洋元素” | B、镁是海水中含量最多的金属元素 | C、从海水中提取食盐和碘的过程都是物理变化 | D、氯碱工业和纯碱工业的原料都有食盐 |
海水是巨大的资源宝库,从海水中提取食盐和溴过程如下:
(1)将NaCl溶液进行电解,在电解槽中可直接得到的新产品有H2、
(2)步骤Ⅱ中用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
(3)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
①实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件
②C中液体产物颜色为
③用离子方程式解释NaOH浓溶液的作用
查看习题详情和答案>>

(1)将NaCl溶液进行电解,在电解槽中可直接得到的新产品有H2、
Cl2
Cl2
_、NaOH
NaOH
或H2、NaClO
NaClO
.(2)步骤Ⅱ中用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
Br2+SO2+2H2O═4H++SO42-+2Br-
Br2+SO2+2H2O═4H++SO42-+2Br-
.(3)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,绘制了如下装置简图:

请你参与分析讨论:
①实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件
利用温度计控制产生蒸气的温度,并收集59℃时的馏分
利用温度计控制产生蒸气的温度,并收集59℃时的馏分
.②C中液体产物颜色为
深红棕色
深红棕色
,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是分液(或蒸馏)
分液(或蒸馏)
.③用离子方程式解释NaOH浓溶液的作用
Br2+2OH-═BrO-+Br-+H2O
Br2+2OH-═BrO-+Br-+H2O
.海水是巨大的资源宝库,下列关于海水综合利用的说法错误的是( )

| A、海水制淡水主要有蒸馏法、电渗析法、离子交换法等 | B、海水制盐、发展氯碱工业都是发生物理变化 | C、海水提溴过程中先通入Cl2将溴离子氧化为溴单质 | D、工业上用电解熔融MgCl2的方法制取金属镁 |
(2009?天津)海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
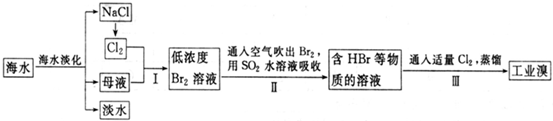
(1)请列举海水淡化的一种方法:
(2)将NaCl溶液电解,在电解槽中可直接得到的产品H2、
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃.微溶于水,有毒性和强腐蚀性.他们参观生产过程后,了解到如下装置:
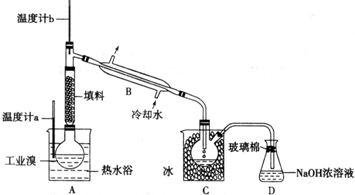
请你参与分析讨论:
①图中仪器B的名称:
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
④C中液体产生颜色为
查看习题详情和答案>>

(1)请列举海水淡化的一种方法:
蒸馏法、电渗析法、离子交换法等中的一种
蒸馏法、电渗析法、离子交换法等中的一种
.(2)将NaCl溶液电解,在电解槽中可直接得到的产品H2、
Cl2
Cl2
、NaOH
NaOH
,或H2、NaClO
NaClO
.(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为
富集溴元素
富集溴元素
.(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
SO2+Br2+2H2O═4H++2Br-+SO42-
SO2+Br2+2H2O═4H++2Br-+SO42-
,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀
强酸对设备的严重腐蚀
.(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃.微溶于水,有毒性和强腐蚀性.他们参观生产过程后,了解到如下装置:

请你参与分析讨论:
①图中仪器B的名称:
冷凝管
冷凝管
.②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
Br2腐蚀橡胶
Br2腐蚀橡胶
.③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
控制温度计b的温度,并收集59℃时的馏分
控制温度计b的温度,并收集59℃时的馏分
.④C中液体产生颜色为
深红棕色
深红棕色
.为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是蒸馏
蒸馏
.