网址:http://m.1010jiajiao.com/timu3_id_86748[举报]
 (2009?广东)甲酸甲酯水解反应方程式为:
(2009?广东)甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)
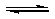 HCOOH(l)+CH3OH(l)△H>0
HCOOH(l)+CH3OH(l)△H>0某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如下表:
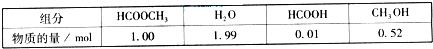
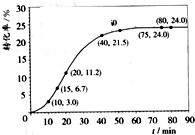
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:

请计算15~20min范围内甲酸甲酯的减少量为
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零.
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零.
(3)上述反应的平衡常数表达式为:K=
| c(HCOOH)?c(CH3OH) |
| c(HCOOCH3)?c(H2O) |
| 1 |
| 7 |
| 1 |
| 7 |
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图.
 甲酸甲酯水解反应方程式为:HCOOCH3+H2O?HCOOH+CH3OH-Q(Q>0)
甲酸甲酯水解反应方程式为:HCOOCH3+H2O?HCOOH+CH3OH-Q(Q>0)某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如表.甲酸甲酯转化率在温度T1下随反应时间(t)的变化如图:
| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |
| c(HCOOH)?c(CH3OH) |
| c(HCOOCH3)?c(H2O) |
| c(HCOOH)?c(CH3OH) |
| c(HCOOCH3)?c(H2O) |
(2)计算15~20min范围内:甲酸甲酯的减少量为
(3)依据以上数据,推断该反应在10min后反应速率迅速加快的原因:
(4)其他条件不变,提高温度为T2,在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图.
(10分)甲酸甲酯水解反应方程式为:
![]()
![]()
![]()
![]()
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
![]()
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:

请计算15~20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率
为 mol?min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
(3)上述反应的平衡常数表达式为:![]() ,则该反应在温度T1下的K值为 。
,则该反应在温度T1下的K值为 。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
查看习题详情和答案>>甲酸甲酯水解反应方程式为:HCOOCH3
+ H2O  HCOOH
+ CH3OH – Q(Q>0)
HCOOH
+ CH3OH – Q(Q>0)
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表。甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
|
组分 |
物质的量/mol |
|
HCOOCH3 |
1.00 |
|
H2O |
1.99 |
|
HCOOH |
0.01 |
|
CH3OH |
0.52 |

(1)上述反应的平衡常数表达式为K=_______________________。
(2)计算15~20min范围内:甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为 mol/min;80~90min范围内甲酸甲酯的平均反应速率为___________ mol/min。
(3)依据以上数据,推断该反应在10min后反应速率迅速加快的原因: 。
(4)其他条件不变,提高温度为T2,在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
查看习题详情和答案>>
甲酸甲酯水解反应方程式为:
![]()
![]()
![]()
![]()
![]()
![]() 某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
![]()
![]()
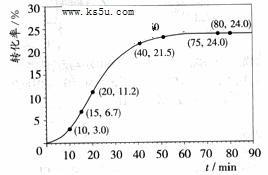
![]() 甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
![]()
![]()
![]() (1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
![]()

![]() 请计算15~20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率
请计算15~20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率
![]() 为 mol?min-1(不要求写出计算过程)。
为 mol?min-1(不要求写出计算过程)。
![]() (2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
![]() (3)上述反应的平衡常数表达式为:
(3)上述反应的平衡常数表达式为:![]() ,则该反应在温度T1下的K值为 。
,则该反应在温度T1下的K值为 。
![]() (4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
![]()