摘要:12.甲醇广泛用作燃料电池的燃料.可用天然气来合成.已知: ①2CH4(g)+O2+4H2(g)ΔH=-71 kJ/mol ②CO(g)+2H2(g)===CH3OH(l)ΔH=-90.5 kJ/mol 下列描述错误的是( ) A.CO(g)+2H2(g)===CH3OH(g)ΔH>-90.5 kJ/mol B.在甲醇燃料电池中.甲醇所在的电极为正极 C.CH4(g)+1/2O2(g)===CH3OH(l)ΔH=-126 kJ/mol D.反应①中的能量变化如图所示 解析:液体汽化时吸收能量.则有:③CH3OH(l)===CH3OH(g) ΔH>0.根据盖斯定律.由②.③可知.CO(g)+2H2(g)===CH3OH(g) ΔH>-90.5 kJ/mol.A正确,甲醇燃料电池中.甲醇所在的电极为负极.B错误,根据盖斯定律.将①×+②可得:CH4(g)+O2(g)===CH3 ΔH=-71 kJ/mol×-90.5 kJ/mol=-126 kJ/mol.C正确,反应①ΔH<0.为放热反应.反应物的总能量高于生成物的总能量.D正确. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_86667[举报]
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H1=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)△H2=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-890kJ/mol
下列说法不正确是( )
①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H1=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)△H2=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-890kJ/mol
下列说法不正确是( )
查看习题详情和答案>>
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)△H=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,不能得出的结论是( )
①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)△H=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,不能得出的结论是( )
| A、甲烷的燃烧热△H=-890kJ/mol | B、当4NA个碳氧共用电子对生成时,反应③放出890kJ的能量 | C、甲醇的燃烧热△H=-1528 kJ/mol | D、若CO的燃烧热△H=-282.5 kJ/mol,则H2的燃烧热△H=-286 kJ/mol |
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g);△H=-71kJ?mol-1
②CO(g)+2H2(g)=CH3OH(l);△H=-90.5kJ?mol-1
下列描述错误的是( )
①2CH4(g)+O2(g)=2CO(g)+4H2(g);△H=-71kJ?mol-1
②CO(g)+2H2(g)=CH3OH(l);△H=-90.5kJ?mol-1
下列描述错误的是( )
| A、CO(g)+2H2(g)═CH3OH(g)△H>-90.5kJ?mol-1 | ||
| B、在甲醇燃料电池中,甲醇所在电极为正极 | ||
C、CH4(g)+
| ||
D、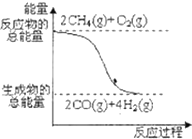 反应①中的能量变化如图所示 |
甲醇广泛用作燃料电池的燃料,可出天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l) △H=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2+2H2O(g) △H=-890kJ/mol
下列说法不能得出的结论是
A、反应②在任何温度下均能自发进行
B.CO(g)+2H2(g)=CH3OH(g)△H>-90.5kJ/mol
C.甲醇的燃烧热为764kJ/mol
D、若CO的燃烧热为282.5kJ/mol,则H2的燃烧热为286kJ/mol
查看习题详情和答案>>|
甲醇广泛用作燃料电池的燃料,可由天然气来合成,已知: ① 2CH4(g)+O2(g)② CO(g)+2H2(g)③ CH4(g)+2O2(g)下列说法不能得出的结论是 | |
| [ ] | |
A. |
在以上三个反应中,都是反应物的总能量大于生成物的总能量 |
B. |
CO(g)+2H2(g) |
C. |
甲醇的燃烧热为 764 kJ/mol |
D. |
若 CO的燃烧热为282.5 kJ/mol,则H2的燃烧热为286 kJ/mol |