网址:http://m.1010jiajiao.com/timu3_id_86665[举报]
已知热化学方程式:
①CO(g)+ 1/2 O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g)+1/2 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
则下列说法正确的是( )
A.H2的燃烧热为241.8kJ·mol-1
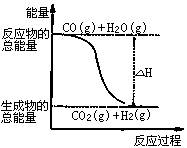
B.由反应①、②可知右图所示的热化学方程式为
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH = -41.2 kJ·mol-1
C.H2(g)转变成H2O(g)的化学反应一定要释放能量
D.根据②推知反应H2(g) +1/2O2 (g)=H2O(l);ΔH>-241.8 kJ·mol-1
查看习题详情和答案>>
 已知热化学方程式:
已知热化学方程式:
①CO(g)+ 1/2 O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g)+1/2 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
则下列说法正确的是( )
A.H2的燃烧热为241.8kJ·mol-1
B.由反应①、②可知右图所示的热化学方程式为
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH = -41.2 kJ·mol-1
C.H2(g)转变成H2O(g)的化学反应一定要释放能量
D.根据②推知反应H2(g) +1/2O2 (g)=H2O(l);ΔH>-241.8 kJ·mol-1
查看习题详情和答案>>A.已知:H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则H2的燃烧热为-241.8 kJ·mol-1 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则H2的燃烧热为-241.8 kJ·mol-1 |
| B.已知:S(g)+O2(g)=SO2(g) ΔH1=-Q1;S(s)+O2(g)=SO2(g) ΔH2=-Q2(Q1、Q2均正值),则Q1<Q2 |
C.已知: H2SO4(浓)+NaOH(aq)= H2SO4(浓)+NaOH(aq)= Na2SO4(aq)+H2O(l) ΔH1;CH3COOH(aq)+NH3·H2O(aq)=CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2| Na2SO4(aq)+H2O(l) ΔH1;CH3COOH(aq)+NH3·H2O(aq)=CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2| |
D.已知:Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol-1;CO(g)+ O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1;C(石墨,s)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1,则4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1641 kJ·mol-1 O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1;C(石墨,s)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1,则4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1641 kJ·mol-1 |
下列有关热化学方程式或反应热的说法正确的是( )
A.已知:H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则H2的燃烧热为-241.8 kJ·mol-1 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则H2的燃烧热为-241.8 kJ·mol-1 |
| B.已知:S(g)+O2(g)=SO2(g) ΔH1=-Q1;S(s)+O2(g)=SO2(g) ΔH2=-Q2(Q1、Q2均正值),则Q1<Q2 |
C.已知: H2SO4(浓)+NaOH(aq)= H2SO4(浓)+NaOH(aq)= Na2SO4(aq)+H2O(l) ΔH1;CH3COOH(aq)+NH3·H2O(aq)=CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2| Na2SO4(aq)+H2O(l) ΔH1;CH3COOH(aq)+NH3·H2O(aq)=CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2| |
D.已知:Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol-1;CO(g)+ O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1;C(石墨,s)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1,则4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1641 kJ·mol-1 O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1;C(石墨,s)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1,则4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1641 kJ·mol-1 |
科学家发现,不管化学反应是一步完成还是分几步完成,该反应的热效应是相同的,已知在25℃、105Pa时,1molC(石墨)完全燃烧生成CO2气体,放热393.5kJ,1molCO完全燃烧生成CO2气体放热283.0kJ,下列说法正确的是 ( )
A.在25℃、105Pa时,C(石墨)完全燃烧生成CO气体的热化学方程式为:2C(石墨)+ O2(g)=2CO(g);△H = -110.5kJ/mol
B.C(石墨)不完全燃烧生成CO和CO2混合气体时,放热283.0 kJ
C.C(石墨)和CO2(气)反应生成CO(气)的反应是吸热反应
D.如果金刚石燃烧生成CO2的反应热大于石墨燃烧生成CO2的反应热,则可以断定从石墨变为金刚石的变化需要吸热
查看习题详情和答案>>