摘要:打开K2后.O2进入广口瓶①与NO反应生成红棕色的NO2:2NO+O2===2NO2.NO2与H2O反应生成HNO3:3NO2+H2O===2HNO3+NO. (2)Ⅰ.根据反应4NO+3O2+2H2O===4HNO3.其中NO的体积为V mL.通入O2的体积为V/2 mL.故O2量不足.剩V/3 mL NO. Ⅱ.若广口瓶①中剩V/2 mL O2.则反应的O2为3V/4 mL.通入O2的总体积=V/2 mL+3V/4 mL=5V/4 mL.若广口瓶①内剩下V/2 mL的气体为NO时.反应V/2 mL NO.故需通入O2的体积为3V/8 mL. 答案:关闭K1.K2.打开K3.从滴定管③上口加水.没过广口瓶①中的长导管口.继续加水.使广口瓶①中的长导管内外出现一段液柱.停止加水.静置一段时间后.若这段液柱不变.说明装置气密性好.反之.说明装置气密性不好
网址:http://m.1010jiajiao.com/timu3_id_85762[举报]
如下图所示装置中,不漏气的是
①装置是用手握试管一段时间,再松开手后的状态
②装置是放入金属Zn和稀硫酸反应又关闭出气口阀门后的状态
③装置是烧瓶内放入金属钠和无水乙醇后的现象
④是广口瓶中装有电石和水,关闭出气口阀门,打开分液漏斗阀门后的现象
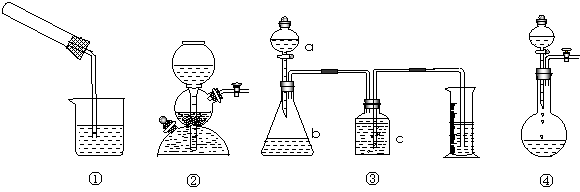
A.①② B.②③ C.①③ D.③④
查看习题详情和答案>>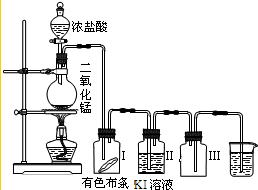 某同学实验室用下列装置探究氯气的性质.
某同学实验室用下列装置探究氯气的性质.(1)实验室用二氧化锰和浓盐酸反应制取氯气,同时生成二氯化锰和水,写出该反应的化学方程式并用单线桥标出电子转移的方向和数目
(2)实验时发现有色布条褪色,其原因是
(3)烧杯中溶液的作用是
A:某同学用下列装置制取氯气并进行氯气的性质实验,请根据描述的实验现象回答下面的几个问题.
(1)据此现象,你认为在书写MnO2和盐酸反应的化学方程式时,一定要注意
(2)查阅资料,干燥的氯气没有漂白作用,但实验时发现广口瓶Ⅰ中干燥的有色布条褪色,其原因是
(3)烧杯中物质为氢氧化钠溶液,其作用是
(4)在探究氯水漂白原因时,为了确证是HClO起了漂白作用,你认为还应增加的实验是:检验
查看习题详情和答案>>

(1)据此现象,你认为在书写MnO2和盐酸反应的化学方程式时,一定要注意
加热
加热
符号的书写和盐酸浓度
浓度
的标注.(2)查阅资料,干燥的氯气没有漂白作用,但实验时发现广口瓶Ⅰ中干燥的有色布条褪色,其原因是
产生的氯气中混有水蒸气
产生的氯气中混有水蒸气
;实验结束后,要从广口瓶Ⅱ中分离得到固态I2,应先进行的操作是萃取
萃取
,然后再作进一步的后续处理.(3)烧杯中物质为氢氧化钠溶液,其作用是
尾气处理,防止环境污染
尾气处理,防止环境污染
.(4)在探究氯水漂白原因时,为了确证是HClO起了漂白作用,你认为还应增加的实验是:检验
盐酸
盐酸
(填物质名称)能否使红色布条褪色.