3.等效平衡--在一定条件下(恒温恒容或恒温恒压),对同一可逆反应,只要起始时加入的物质的物质的量不同,而达到平衡时,同种物质的百分含量相同,这样的两种平衡状态称为等效平衡。若达到平衡时,不仅同种物质的百分含量相同,且同种物质的物质的量、浓度均相同,这样的两种平衡状态称为等同平衡。(等同平衡是等效平衡的一种特例)
练习1、一定温度下,把2molSO2和1molO2通入一个固定体积的密闭容
器中,发生如下反应2SO2(g) + O2(g) ≒2SO3 (g),当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、 O2、SO3的物质的量(mol),如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡状态时反应混合物中三种气体的百分含量仍然跟上述平衡时完全相同。请填写下列空白:
|
编号 |
起 始 状 态 |
平衡时SO3% |
平衡时SO3的物质的量(mol) |
||
|
SO2(a) |
O2(b) |
SO3(c) |
|||
|
1 |
2 |
1 |
0 |
a% |
m |
|
2 |
0.5 |
0.25 |
1.5 |
a% |
m |
|
3 |
1 |
0.5 |
1 |
a% |
m |
|
4 |
0 |
0 |
2 |
a% |
m |
|
5 |
4 |
2 |
0 |
> a% |
> m |
|
6 |
a、 b、 c满足的一般条件 a+c=2、 b+c/2=1(或a=2b、a+b+3c/2=3) |
a% |
m |
总结:对于反应前后气体体积不等的可逆反应,在恒温恒容的条件下,只要改变起始加入物质的物质的量,如果通过可逆反应的化学计量数比换算成平衡式左右两边同一边物质的物质的量与原平衡相同,则量两平衡等效。
练习2、一定温度下,把2molSO2和1molO2通入一个容积可变的密闭容
器中,发生如下反应2SO2(g) + O2(g) ≒2SO3 (g),当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、 O2、SO3的物质的量(mol),如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡状态时反应混合物中三种气体的百分含量仍然跟上述平衡时完全相同。请填写下列空白:
|
编号 |
起 始 状 态 |
平衡时SO3% |
平衡时SO3的物质的量(mol) |
||
|
SO2(a) |
O2(b) |
SO3(c) |
|||
|
1 |
2 |
1 |
0 |
a% |
m |
|
2 |
0.5 |
0.25 |
1.5 |
a% |
m |
|
3 |
1 |
0.5 |
1 |
a% |
m |
|
4 |
0 |
0 |
2 |
a% |
m |
|
5 |
4 |
2 |
0 |
a% |
2m |
|
6 |
b、 b、 c满足的一般条件 (a+c)/(b+c/2)=2 |
a% |
m |
总结:对于反应前后气体体积不等的可逆反应,在恒温恒压的条件下,,改变起始加入物质的物质的量的情况,只要按化学计量数换算成平衡式左右两边同一边物质的物质的量之比与原平衡相同,则达到平衡后与原平衡等效。
练习3、在一个固定体积的密闭容器中,保持温度一定,进行以下反应:
H2(g)+Br2(g)≒2HBr(g),已知1mol H2和2mol Br2时,达到平衡状态后生成amol HBr(见下表已知项),在相同条件下,且保持平衡时,各组成成分的百分含量不变,对下列编号(1)~(3)的状态,请填写表中空白:
|
编号 |
起 始 状 态(mol) |
平衡时HBr的物质的量(mol) |
||
|
H2 (a) |
Br2
(b) |
HBr (c) |
||
|
已知 |
1 |
2 |
0 |
a |
|
1 |
0.5 |
1.5 |
1 |
a |
|
2 |
2 |
4 |
0 |
2a |
|
3 |
0 |
0.5 |
1 |
0.5a |
|
4 |
m |
n(n≥2m) |
2(n-2m) |
a(n-m) |
总结:对于反应前后气体体积相等的可逆反应,在恒温恒容的条件下,,改变起始加入物质的物质的量的情况,只要按化学计量数换算成平衡式左右两边同一边物质的物质的量之比与原平衡相同,则达到平衡后与原平衡等效。
练习4、在一个容积可变的密闭容器中,保持温度一定,进行以下反应:
H2(g)+Br2(g)≒2HBr(g),已知1mol H2和2mol Br2时,达到平衡状态后生成amol HBr(见下表已知项),在相同条件下,且保持平衡时,各组成成分的百分含量不变,对下列编号(1)~(3)的状态,请填写表中空白:
|
编号 |
起 始 状 态(mol) |
平衡时HBr的物质的量(mol) |
||
|
H2 (a) |
Br2
(b) |
HBr (c) |
||
|
已知 |
1 |
2 |
0 |
a |
|
1 |
0.5 |
1.5 |
1 |
a |
|
2 |
2 |
4 |
0 |
2a |
|
3 |
0 |
0.5 |
1 |
0.5a |
|
4 |
m |
n(n≥2m) |
2(n-2m) |
a(n-m) |
总结:对于反应前后气体体积相等的可逆反应,在恒温恒容的条件下,,改变起始加入物质的物质的量的情况,只要按化学计量数换算成平衡式左右两边同一边物质的物质的量之比与原平衡相同,则达到平衡后与原平衡等效。
练习5、在一密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol B:0.3mol C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x的值为(C)
xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol B:0.3mol C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x的值为(C)
A.只能为2 B.只能为3
C.可能是2,也可能是3 D.无法确定
练习6、在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应:2A(g)+B(g)  3C(g)+D(g)达到平衡时,C的浓度为W mol·L-1,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为W mol·L-1的是
3C(g)+D(g)达到平衡时,C的浓度为W mol·L-1,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为W mol·L-1的是
A.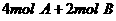
B.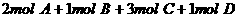
C.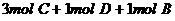
D.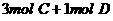
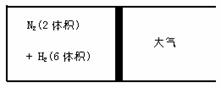 练习7、在一定的温度下, 将 2体积的氮气和 6 体积的氢气通入一个带活塞的容器中, 活塞的一段与大气相通(如下图), 容器内发生以下反应: N2(g)+3H2(g)
练习7、在一定的温度下, 将 2体积的氮气和 6 体积的氢气通入一个带活塞的容器中, 活塞的一段与大气相通(如下图), 容器内发生以下反应: N2(g)+3H2(g)  2NH3(g) +Q(Q>0), 若反应达到平衡时, 测得混合气体的总体积为 7 体积, 据此回答下列有关问题:
2NH3(g) +Q(Q>0), 若反应达到平衡时, 测得混合气体的总体积为 7 体积, 据此回答下列有关问题:
(1) 保持上述反应的温度不变, 设a、b、c分别代表初始加入的 N2、H2、NH3 的体积, 如果反应达到平衡后混合气体中各物质的量与上述平衡完全相同, 则:
①若a =1, c =2, 则 b =______, 在此情况下, 反应起始时将向______方向进行(填写 “正” 或 “逆”)
②若需规定起始时反应向逆反应方向进行, 则c 的取值范围是______。
(2) 在上述装置中, 若要控制平衡后混合气体为 6.5 体积, 则可以采取的措施______, 原因是 ________________________.
⑴①3 ;逆 ② 1≤c≤4 ⑵降温 ; 合成氨反应是放热反应,其他条件不变,降温能使平衡向放热方向移动,即向气体体积减小的方向移动,使平衡混合气体由7体积变为6.5体积。
练习8、在一个固定体积的密闭容器中,保持一定温度,在一定条件下进行如下反应: A(g)+2B(g)  3C(g),已知起始时加入1molA和3molB且达到平衡后,生成了3molC。
3C(g),已知起始时加入1molA和3molB且达到平衡后,生成了3molC。
(1)当反应达到平衡时C在反应混合气体中的体积分数为 0.25a (用字母a来表示)。
(2)相同实验条件下,若在同一容器中改为起始时加入2molA和6molB,达到平衡时,C的物质的量为 2a (用字母a来表示),此时C在反应混合气体中的体积分数为 0.25a (用字母a来表示)。
(3)相同实验条件下,若在同一容器中改为起始时加入2molA和8molB,达到平衡时,达到平衡时要求C在混合物中体积分数与(2)相同,则开始时还须加入C 6 mol。
练习9、把氮气和氢气以1:1物质的量的比混合均匀后分成四等份,分别同时充入A、B、C、D四个装有催化剂的真空密闭容器中(容器的容积固定),在保持相同温度的条件下,四个容器中的合成氨反应相继达到化学平衡状态。分析表中实验数据后回答问题(用A、B、C、D填空)
|
容 器 代 号 |
A |
B |
C |
D |
|
平衡时混合物种的平均相对分子质量 |
|
|
16 |
17 |
|
平衡时氮气的转化率 |
20% |
|
|
|
|
平衡时氢气的转化率 |
|
30% |
|
|
(1)都达到平衡时, A 容器中氨气的物质的量所占比例最大
(2)达到平衡时所需时间最长的容器代号为 B
(3)四个容器的容积由小到大的排列次序是 A<D<B<C
练习10、(I)恒温、恒容下,在一个可变容积的容器中发生如下反应
A(g)+B(g)  C(g)
C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成amolA,这时A的物质的量为 1-a mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 3a mol。
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别为ymol和3amol,则x= 2 mol,y= 3-3amol。
平衡时,B的物质的量 丁 。(甲)大于2mol;(乙)等于2mol;(丙)小于2mol;(丁)可能大于、等于或小于2mol。做出此判断的理由是 若3a>1,B的物质的量小于2mol; 若3a=1,B的物质的量等于2mol; 若3a<1,B的物质的量大于2mol; 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 a/(2-a) 。
(II)若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应
(5)开始时放入1molA和1molB到达平衡后生成bmolC。将与(1)小题中的a进行比较 乙 。(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小。做出此判断的理由是 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题中的容器中的压力小于(1)小题中容器中的压力,有利于逆向反应,故反应达到平衡后a>b 。
2.外界条件对化学平衡的影响:
(1) 化学平衡移动的原因及平衡移动方向的判断
(2)外界条件对化学平衡的影响及勒夏特列原理
温度--在其它条件不变的情况下,增大反应物浓度或减少生成物浓度,平衡向正反应方向移动;增大生成物浓度或减少反应物浓度,平衡向逆反应方向移动。(即在其它条件不变的情况下,改变某一物质的浓度,则平衡向着减弱该物质浓度改变的方向移动。)
注意:①增减固体或纯液体的量,对化学反应速率无影响,对化学平衡也无影响。②增大平衡体系中某一反应物的浓度,可以提高另一反应物的转化率。
压强--在其它条件不变的情况下,对于有气体参加的反应,增大压强,平衡向气体体积减小的方向移动;减小压强,平衡向气体体积增大的方向移动。(即在其它条件不变的情况下,对于有气体参加的反应,改变压强,则平衡向着减弱压强改变的方向移动。)
注意:①必须有气体参加的平衡体系;②改变压强实际上是通过等倍数改变体系中各物质的浓度来影响化学平衡的。③充入与反应无关的气体(惰性气体)时对化学平衡的影响:
|
外界条件 |
aA(g) + bB(g) == cC(g) |
|||
|
a+b=c |
a+b>c |
|||
|
速率变化 情 况 |
平衡移动 情 况 |
速率变化 情 况 |
平衡移动 情 况 |
|
|
恒温恒容 |
不 变 化 |
不 移 动 |
不 变 化 |
不 移 动 |
|
恒温恒压 |
速率等倍数减小 |
不 移 动 |
速率等倍数减小 |
逆向移动 |
温度--在其它条件不变的情况下,升高温度,平衡向气体吸热反应的方向移动;降低温度,平衡向放热反应的方向移动。(即在其它条件不变的情况下,改变温度,则平衡向着减弱温度改变的方向移动。)
催化剂--加入催化剂,能够同等程度的加快正逆反应的速率,平衡不移动。
勒夏特列原理(平衡移动原理)--如果改变影响平衡的一个条件(如温度、压强、浓度等),则平衡向着能够减弱条件改变的方向移动。
注意:①适用范围--所有的平衡体系(可逆反应、溶解、电离、水解、络合等);②对于不能使化学平衡发生移动的外界条件,不能用勒夏特列原理(如催化剂、合成氨对温度的选择、反应前后气体体积相等的反应改变压强);③平衡移动的结果是减弱条件的改变,而不是消除条件的改变。
1.概念:在一定条件下的可逆反应里,正反应和逆反应速率相等,反应混合物中各组成成分的含量保持不变的状态叫做化学平衡状态。
平衡状态的特征:等、定、动、变。
平衡标志:等、定
|
序号 |
2SO2(g) + O2(g) ≒2SO3 (g) |
|
|
1 |
单位时间内生成nmol SO2的同时生成nmol SO3 |
√ |
|
2 |
单位时间内生成nmol SO2的同时消耗nmol SO3 |
× |
|
3 |
百分组成SO2%= SO3% |
× |
|
4 |
反应速率V(SO2)=2V(O2)= V(2SO3)时 |
× |
|
5 |
c(SO2):c(O2): c(SO3)=2:1:2时 |
× |
|
6 |
恒温恒容时,某一生成物的浓度不再变化 |
√ |
|
7 |
恒温恒容时,容器内的压强不变 |
√ |
|
8 |
条件一定,混合气体的平均相对分子质量不再变化 |
√ |
|
9 |
恒温恒压时,混合气体的密度不再变化 |
√ |
|
10 |
恒温恒容时,混合气体的密度不再变化 |
× |
|
11 |
混合气体的总的物质的量不再变化 |
√ |
|
12 |
混合气体的总质量不再变化 |
× |
|
13 |
恒温恒压时,混合气体的总体积不再变化 |
√ |
|
序号 |
H2(g)+I2(g)≒2HI(g) |
|
|
1 |
单位时间内生成nmolH2的同时生成nmolHI |
× |
|
2 |
一个H-H键断裂的同时有两个H-I键断裂 |
√ |
|
3 |
百分组成HI%=I2% |
× |
|
4 |
反应速率V(H2)=V(I2)=1/2V(HI)时 |
× |
|
5 |
c(HI):c(H2): c(I2)=2:1:1时 |
× |
|
6 |
恒温恒容时,某一生成物的浓度不再变化 |
√ |
|
7 |
恒温恒容时,容器内的压强不变 |
× |
|
8 |
条件一定,混合气体的平均相对分子质量不再变化 |
× |
|
9 |
恒温恒容时,混合气体的颜色不再变化 |
√ |
|
10 |
恒温恒压时,混合气体的密度不再变化 |
× |
|
11 |
恒温恒容时,混合气体的密度不再变化 |
× |
|
12 |
混合气体的总的物质的量不再变化 |
× |
|
13 |
混合气体的总质量不再变化 |
× |
|
14 |
恒温恒压时,混合气体的总体积不再变化 |
× |
2.影响化学反应速率的外界条件
活化能--反应所需要的能量(分子本身所具有的能够使旧的化学键断开的最低能量)
活化分子--具有比普通分子更高的能量即本身能量超过活化能的分子(可能发生有效碰撞--需要合适的取向)
有效碰撞--能够发生化学反应的碰撞
(活化分子可以发生有效碰撞,但不一定发生有效碰撞,受到碰撞取向的影响;发生有效碰撞的分子一定是活化分子。)
活化分子百分数--活化分子数占分子总数的百分数。当其它条件(温度、催化剂)不变时,活化分子百分数是一定的。
|
影响因素 |
单位体积 分子总数 |
活化能 |
活化分子百分数 |
单位体积活化分子总数 |
速率变化 |
|
增大浓度 |
变 大 |
不变化 |
不变化 |
变 大 |
变快 |
|
增大压强 |
变 大 |
不变化 |
不变化 |
变 大 |
变快 |
|
升高温度 |
不变化 |
不变化 |
变 大 |
不变化 |
变快 |
|
加催化剂 |
不变化 |
变 小 |
变 大 |
变 大 |
变快 |
注意:(1)增减固体或纯液体的量对化学反应的速率没有影响;
(2)压强的改变是通过改变容器的容积或等倍数增减各组分的量来实现的。若只改变某一组分的量不能认为是改变了压强。
(3)充入惰性气体,对化学反应速率产生的影响:恒容时无影响,恒压时对反应前后气体体积有变化的反应产生影响,相当于减小压强,会使化学反应速率减小。
 练习4、判断反应 (放热)的速率变化
练习4、判断反应 (放热)的速率变化
|
改变的条件 |
速 率 变
化 |
|
增大SO2的浓度 |
加 快 |
|
增大容器的容积 |
减 慢 |
|
降低温度 |
减 慢 |
|
再加等倍数的三种气体 |
加 快 |
|
恒容时充入N2 |
不 变 |
|
恒压时充入N2 |
减 慢 |
练习5、(1)一定量的稀硫酸跟过量的锌粉反应,在一定温度下,为了减缓反应的速率,但又不影响生成氢气的总量,可向反应物中加入适量的(BCF)
A.硫酸钠固体 B.水 C.氯化钠溶液 D.硝酸钾溶液
E.少量铜粉 F.醋酸钠固体 G.少许浓硫酸 H.加热 I.少量硫酸铜溶液
(2)一定量的稀硫酸跟过量的锌粉反应,在一定温度下,为了加快反应的速率,但又不影响生成氢气的总量,可向反应物中加入适量的(EHI )
A.硫酸钠固体 B.水 C.氯化钠溶液 D.硝酸钾溶液
E.少量铜粉 F.醋酸钠固体 G.少许浓硫酸 H.加热 I.少量硫酸铜溶液
(3)一定量的锌粉跟过量的稀硫酸反应,在一定温度下,为了加快反应的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( EGH )
A.硫酸钠固体 B.水 C.氯化钠溶液 D.硝酸钾溶液
E.少量铜粉 F.醋酸钠固体 G.少许浓硫酸 H.加热 I.少量硫酸铜溶液
练习6、下列各组溶液,同时开始反应,出现混浊最早的是(C)
|
序号 |
温度(0C) |
Na2S2O3溶液 |
H2SO4溶液 |
||
|
A |
10 |
5mL |
0.1mol/L |
5mL |
0.1mol/L |
|
B |
10 |
50mL |
0.05mol/L |
5mL |
0.1mol/L |
|
C |
20 |
5mL |
0.1mol/L |
5mL |
0.1mol/L |
|
D |
20 |
50mL |
0.05mol/L |
5mL |
0.1mol/L |