2.某实验小组对甲、乙、丙、丁四种固体样品的性质进行测试,结果如下表:
|
物质 性质 |
甲 |
乙 |
丙 |
丁 |
|
熔点 |
高 |
低 |
高 |
低 |
|
水溶性 |
溶 |
不溶 |
不溶 |
溶 |
|
高温 |
稳定 |
分解 |
稳定 |
稳定 |
|
导电性 |
导电 |
不导电 |
不导电 |
导电 |
则这四种固体物质中最可能是有机物的是( )
A.甲 B.乙 C.丙 D.丁
解析:据有机物一般不易溶于水、不导电、熔点较低的特点判断乙物质可能
是有机物。
答案:B
5.(2010·盐城中学期中考题)X、Y、Z、W和N均是由短周期元素组成的五种化合物。已知五种化合物的焰色反应均呈黄色,Y、Z和N均由三种元素组成。请根据题目要求回答下列问题。
(1)固体化合物X为浅黄色粉末,该化合物中含有的化学键有( )
A.离子键 B.极性共价键
C.非极性共价键 D.氢键
(2)写出X与二氧化碳反应的化学方程式_________________________________。
(3)下表为Y与Z实验的部分内容:
|
序号 |
主要实验步骤及实验现象 |
|
① |
在含Y的溶液中,加入稀硫酸溶液,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色。 |
|
② |
在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀。 |
|
③ |
将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体。 |
写出Y与稀硫酸反应的离子方程式______________________________________。
(4)写出含0.1 mol Z的溶液与20 mL 5 mol/L的盐酸反应的离子方程式______。
实验③加热蒸发、灼烧得到的最终产物主要是__________________________。
(5)化合物W和N可以相互转化:W△CO2+H2ON。若有W和N·xH2O的混合物6.52 g,加热到完全反应后,气体产物通过浓H2SO4时浓H2SO4增重1.71 g,剩余气体通过碱石灰时碱石灰增重1.10 g,则混合物中W的质量为________,N·xH2O的化学式为____________。
解析:(1)依据焰色反应现象知,五种化合物都含有钠元素,根据X的颜色知,它是过氧化钠,Na+与O22-之间存在离子键,O22-中氧与氧之间存在非极性共价键。(3)据实验现象:Y+H2SO4―→S↓+SO2↑等,联想高二化学学生实验二“化学反应速率和化学平衡”中化学反应原理:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,可知Y为硫代硫酸钠。又根据“Z+盐酸―→白色沉淀,白色沉淀+盐酸―→溶液,溶液+氨水―→白色沉淀”,由短周期元素组成的物质中只有偏铝酸钠符合题意,Z为偏铝酸钠。灼烧氢氧化铝:2Al(OH)3Al2O3+3H2O。(4)n(HCl)=20×10-3L×5 mol/L=0.1 mol,n(HCl)=n(NaAlO2),NaAlO2+HCl+H2O===Al(OH)3↓+NaCl。(5)根据W、N转化关系,“CO2+H2O”暗示:W为碳酸氢钠,N为碳酸钠。设W、N·xH2O的物质的量分别为a,b。根据混合物质量得:
84 g·mol-1×a+(106+18x)g·mol-1×b=6.52 g①
2NaHCO3Na2CO3+CO2↑+H2O
a a/2 a/2
Na2CO3·xH2ONa2CO3+xH2O
b bx
根据浓硫酸净增质量得:
(a/2+bx)×18 g·mol-1=1.71 g②
根据碱石灰净增质量得:a/2×44 g·mol-1=1.10 g③
联立①②③方程解得:a=0.05 mol,b=0.01 mol,x=7。
m(NaHCO3)=0.05 mol×84 g·mol-1=4.2 g。
答案:(1)AC
(2)2CO2+2Na2O2===2Na2CO3+O2
(3)S2O32-+2H+===S↓+SO2↑+H2O
(4)AlO2-+H++H2O===Al(OH)3↓ Al2O3
(5)4.2 g Na2CO3·7H2O
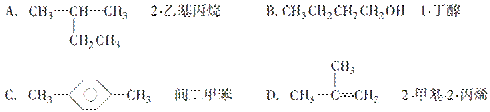

 如图所示:一端封闭的U型管,封闭着的一端有一段CH4和Cl2的混合
如图所示:一端封闭的U型管,封闭着的一端有一段CH4和Cl2的混合 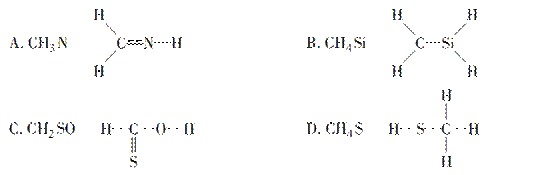
 ,A说法错误。
,A说法错误。