15.(2009·杭州5月模拟)在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42-+2MnO4-+16H+===10CO2↑+2Mn2++8H2O。以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为1.5×10-2 mol·L-1的高锰酸钾溶液500 mL。
步骤二:准确称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70-80℃,用步骤一所配高锰酸钾溶液进行滴定。三次平行实验的数据记录在下表中:
|
平行实验编号 |
Na2C2O4质量(g) |
滴定管起始读数(mL) |
滴定管滴定终点读数(mL) |
|
1 |
1.380 |
0.00 |
25.02 |
|
2 |
1.400 |
0.02 |
25.40 |
|
3 |
1.390 |
0.18 |
24.88 |
试回答下列问题:
(1)步骤一中要用到的主要玻璃仪器是除烧杯外还需________、________。
(2)步骤二中滴定操作图示正确的是________(填编号)。
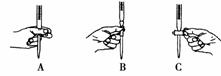
(3)步骤二的滴定过程温度变化并不明显,但操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是___________________________________________。
(4)从实验所得数据计算,KMnO4溶液的浓度为__________ mol·L-1。
解析:此题主要考查滴定和相关计算问题。解此类题目,要求考生掌握有关滴定管的使用、滴定的有关计算、影响化学反应速率的因素。(1)粗略配制高锰酸钾溶液,体积不要求精确,故用量筒代替容量瓶即可。(2)高锰酸钾有氧化性,腐蚀胶管,应用酸式滴定管盛放。(3)影响速率的因素在这里只能从催化剂、浓度两个角度来考虑。(4)计算时,可以将质量和体积分别取平均值后再计算。
答案:(1)量筒 玻璃棒(少答或多答不给分)
(2)A
(3)生成的Mn2+为催化剂,使反应速率变大
(4)0.165 8
 2SO3中,投入2 mol SO2、1 mol O2充分反应后,转移电子数为4NA
2SO3中,投入2 mol SO2、1 mol O2充分反应后,转移电子数为4NA ②测定从胶头滴管滴出的每滴液体的体积;
②测定从胶头滴管滴出的每滴液体的体积;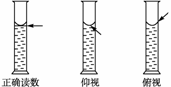
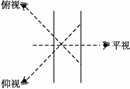 Ⅱ.对量筒读数的分析应分两种情况,本题涉及的是量取一定体积的液体,即数值一定,只是添加液体的多少问题;另一类是量筒内所盛液体的凹液面一定,去读数,仰视读数偏小,俯视读数偏大,如图:
Ⅱ.对量筒读数的分析应分两种情况,本题涉及的是量取一定体积的液体,即数值一定,只是添加液体的多少问题;另一类是量筒内所盛液体的凹液面一定,去读数,仰视读数偏小,俯视读数偏大,如图: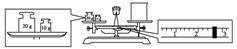 (2010·模拟题)(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,该同学在操作时的一个错误是____________________,烧杯的实际质量为________g。
(2010·模拟题)(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,该同学在操作时的一个错误是____________________,烧杯的实际质量为________g。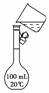
 答案:(1)烧杯 玻璃棒 500 mL容量瓶 胶头滴管 14.6
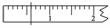
答案:(1)烧杯 玻璃棒 500 mL容量瓶 胶头滴管 14.6 ①天平调平之后,应将天平的游码调至某个位置,请在右图中用一根竖线标出游码左边缘所处的位置:
①天平调平之后,应将天平的游码调至某个位置,请在右图中用一根竖线标出游码左边缘所处的位置: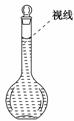 第八步:将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标
第八步:将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标