9.下表是周期表的一部分,表中所列的字母分别代表某一化学元素。
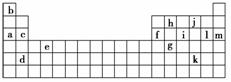
(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k
③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:原子核对核外电子的吸引力;形成稳定结构的倾向。
一些原子核失去核外不同电子所需的能量(kJ·mol-1)
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7 296 |
4 570 |
1 820 |
|
失去第三个电子 |
11 799 |
6 920 |
2 750 |
|
失去第四个电子 |
|
9 550 |
11 600 |
①通过上述信息和表中的数据分析,为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量______________________________________。
②表中X可能为以上13种元素中的________(填写字母)元素。用元素符号表示X和j形成的化合物的化学式________。
③Y是周期表中________族元素。
④以上13种元素中,________(填写字母)元素原子失去核外第一个电子需要的能量最多。
解析:(1)从所给元素在周期表中的位置不难知道,a、c、d、f分别为Na、Mg、Sr和Al,e处于过渡元素区,也一定为金属,它们都是电的良导体;h为碳元素,其单质中的一种石墨也是电的良导体,故应选①、④两组。
(2)①锂原子核外共有3个电子,其中两个在K层,1个在L层,当失去最外层的一个电子后,锂离子处于稳定结构,根据题给信息可知,要使锂离子再失去电子便会形成不稳定结构,因此锂原子失去第二个电子时所需能量远大于失去第一个电子所需的能量。
②由表中数据可知:X失去第2个电子所需能量远大于失去第一个电子所需的能量(9倍多),而失去第三个、第四个电子所需能量皆不足前者的两倍,故第一个电子为最外层的1个电子,而其他几个电子应处于内层。结合所给的周期表知,X应为a,即钠元素,和j即氧元素所形成的化合物化学式分别为Na2O和Na2O2。
③由表中所给Y的数据可知,Y失去第1、2、3个电子所需能量差别不大,而失去第4个电子所需能量远大于失去第3个电子所需的能量,因此Y元素的最外层有3个电子,即为ⅢA族的元素Al。
④从题目所给信息知道,原子失电子所需能量不仅与原子核对核外电子的吸引力有关,还与形成稳定结构的倾向有关。结构越稳定失电子所需能量越高,在所给13种元素中,处于零族的m元素已达8e-的稳定结构,因此失去核外第一个电子需要的能量最多。
答案:(1)①④ (2)①Li原子失去1个电子后形成稳定结构,此时再失去1个电子很困难 ②a Na2O和Na2O2 ③ⅢA ④m
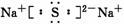 (3)酸
(3)酸  Al(OH)3+3H+ (4)SO2+Cl2+2H2O===H2SO4+2HCl (5)HCl H2S (6)S2- Cl- Na+ Al3+ (7)Cl2O7(1)+H2O(1)===2HClO4(aq);ΔH=-4Q kJ/mol
Al(OH)3+3H+ (4)SO2+Cl2+2H2O===H2SO4+2HCl (5)HCl H2S (6)S2- Cl- Na+ Al3+ (7)Cl2O7(1)+H2O(1)===2HClO4(aq);ΔH=-4Q kJ/mol