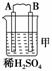
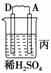
11.由A、B、C、D四种金属按下表中装置进行实验。
|
装置 |
 |
 |
 |
|
现象 |
二价金属A 不断溶解 |
C的质量 增加 |
A上有气 体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是_________________________________________。
(2)装置乙中正极的电极反应式是_________________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是_____________________________________。
解析:甲、乙、丙均为原电池装置。依据原电池原理,甲中A不断溶解,则A为
负极、B为正极,活泼性A>B;乙中C极增重,即析出Cu,则B为负极,活泼性
B>C;丙中A上有气体即H2产生,则A为正极,活泼性D>A,随着H+的消耗,pH
变大。

 答案:(1)A-2e-
A2+ (2)Cu2++2e-
Cu (3)变大 (4)D>A>B>C
答案:(1)A-2e-
A2+ (2)Cu2++2e-
Cu (3)变大 (4)D>A>B>C
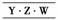 或
或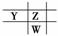 ,再结合
,再结合

 O2+2H2O+4e-
4OH-
O2+2H2O+4e-
4OH-
 (3)Na-e- Na+ Sx2--2e- xS (4)69 g
(3)Na-e- Na+ Sx2--2e- xS (4)69 g 是原电池的负极:Zn-2e- Zn2+;Pt作为原电池的正极,由于人体体液不可能
是原电池的负极:Zn-2e- Zn2+;Pt作为原电池的正极,由于人体体液不可能