12.有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)
|
阳离子 |
Na+、Ba2+、NH4+ |
|
阴离子 |
CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B两溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是__________,B是__________,C是________,D是________;
(2)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为:______________。
解析:由A、C两溶液的pH>7,结合离子共存可推知,A、C为Ba(OH)2、CH3COONa中的一种,又由A、B溶液中水的电离程度相同,知A、B水解程度相近,即水解形成的弱酸或弱碱的电离程度相近,进而推知A、B为CH3COONa、NH4Cl中的一种,再结合C溶液和D溶液相遇时只产生白色沉淀、B溶液和C溶液相遇时只产生刺激性气味的气体、A溶液和D溶液混合时无明显现象,推出A为CH3COONa,B为NH4Cl,C为Ba(OH)2,D为Na2SO4。当B、C混合时,发生反应NH4++OH-===NH3↑+H2O,故等体积等物质的量浓度的NH4Cl与Ba(OH)2混合时,各离子浓度由大到小的顺序为:c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+)。
答案:(1)CH3COONa NH4Cl Ba(OH)2 Na2SO4
(2)c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+)
10. (2008·宿迁调研)某研究性学习小组在整理实验室化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损,如图。某同学根据中学化学知识,对该试剂可能是什么物质的溶液进行了如下猜想和验证,选择你认为错误(包括猜想物质的化学式、检验需要的试剂、操作、现象及结论)的选项( )
(2008·宿迁调研)某研究性学习小组在整理实验室化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损,如图。某同学根据中学化学知识,对该试剂可能是什么物质的溶液进行了如下猜想和验证,选择你认为错误(包括猜想物质的化学式、检验需要的试剂、操作、现象及结论)的选项( )
|
选项 |
猜想物质 的化学式 |
检验需要 的试剂 |
操作、现象及结论 |
|
A |
Na2SO4 |
稀盐酸、氯化钡溶液 |
取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
|
B |
Na2CO3 |
稀盐酸、澄清的石灰水 |
取少量该溶液于试管中,滴入稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
|
C |
Na2SO3 |
稀盐酸、澄清的石灰水、品红溶液 |
取少量该溶液于试管中,滴入稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
|
D |
Na2SiO3 |
过量稀盐酸 |
取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
解析:B项的猜想和结论不相符,SO2也可使澄清的石灰水变浑浊。
答案:B
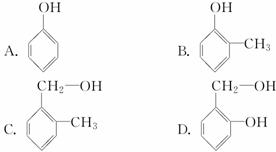

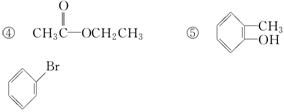
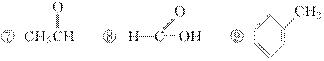
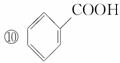
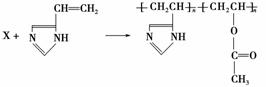
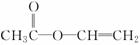
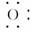
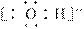 D.羟基比氢氧根稳定
D.羟基比氢氧根稳定

 解析:此题的主要目的是:既除去原混合溶液中的Ba2+,但又不能引入新的杂质(如Na+或SO42-)。解题思路如下:
解析:此题的主要目的是:既除去原混合溶液中的Ba2+,但又不能引入新的杂质(如Na+或SO42-)。解题思路如下: