14.苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过如下图所示的流程由甲苯氧化制备苯甲醛。
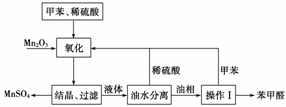
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是________________________________________________________________________。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离。该过程中需将混合物冷却,其目的是
________________________________________________________________________。
(3)实验过程中,可循环使用的物质分别为__________、______________。
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ是________,
其原理是____________________________________________________________________。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表)。
|
反应时间/h |
1 |
2 |
3 |
4 |
5 |
|
苯甲醛产率/% |
76.0 |
87.5 |
83.6 |
72.5 |
64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因________________________________________________________________________。
解析:本题以医药、染料、香料等行业广泛应用的苯甲醛的制备为背景考查了结晶和蒸馏两种物质分离的基本方法,既考查了实验能力和分析评价能力,又考查烃及烃的衍生物的相互转化及醛基官能团的性质。
(1)搅拌可以使Mn2O3与甲苯充分接触,加快反应速率;
(2)从流程图可以看出“结晶过滤”可得晶体MnSO4,因此,将混合物冷却的目的一定是降低MnSO4的溶解度有利于MnSO4的析出。
(3)从流程图可直接看出甲苯可循环使用,而稀H2SO4在甲苯的氧化过程中仅起介质作用,油水分离后也可循环使用。
(4)根据制备原理,油层含有的物质为苯甲醛和未被氧化的甲苯,而这两者是互溶物,只能利用它们的沸点不同,利用蒸馏(或分馏)的方法分离。
(5)从所给数据看,随时间的延长,苯甲醛的产率降低,根据苯甲醛中所含醛基易被氧化,可分析其原因肯定是苯甲醛被氧化导致。
答案:(1)使反应物充分接触,增大反应速率
(2)降低MnSO4的溶解度 (3)稀硫酸 甲苯
(4)蒸馏 利用甲苯和苯甲醛的沸点差异使二者分离
(5)部分苯甲醛被氧化成苯甲酸
12.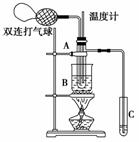 (2009·正定中学月考)乙醛在催化剂存在的条件下,可以被空气氧
(2009·正定中学月考)乙醛在催化剂存在的条件下,可以被空气氧
化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙
酸溶液(如图所示,试管A中装有40%的乙醛水溶液、铜粉,试管
C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃-80℃
时,用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十
几次,反应基本完全。有关物质的沸点如下:
|
物质 |
乙醛 |
乙酸 |
甘油 |
水 |
|
沸点/℃ |
20.8 |
117.9 |
290 |
100 |
请完成下列问题:
(1)试管A内在60℃-80℃时发生的主要反应的化学方程式为(注明反应条件)________。
(2)如图所示,在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在________;当试管A内主要反应完成后,温度计水银球的位置应在________,目的是________________________。
(3)烧杯B的作用是________________________________________________________________________;
烧杯B内盛装的液体可以是________(选填“甘油”或“水”)。
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。
所提供的药品有:pH试纸,红色的石蕊试纸,白色的醋酸铅试纸,碳酸氢钠粉末。实验仪器任选。
该方案为(简述操作过程):________________________________________________________________________。
解析:综观全题,可知本实验的原理是:用双连打气球鼓入空气,使空气中的氧气与A中的乙醛在温度为60℃-80℃时反应生成乙酸,因乙酸是液体,要在C中收集到乙酸,须使A中混合液的沸点在117.9℃以上(由题中信息得出),从图示装置可以看出,该反应采取了水浴加热的方式,若要使反应正常进行,并使乙酸顺利蒸出,所选溶液的沸点必须比117.9℃高,根据题中信息,只能选择甘油。乙酸最典型的性质就是它的酸性,故要检验C中是否含有乙酸的设计方案应以此为切入点。分析题中提供的四种试剂,红色石蕊试纸、白色的醋酸铅试纸不能选用(因石蕊试液遇酸变红色;醋酸铅与乙酸不反应),则方案设计时便可从pH试纸和NaHCO3粉末着手。
答案:(1)2CH3CHO+O2Cu△2CH3COOH
(2)试管A的反应液中 略低于试管A的支管口处 收集含乙酸的馏分
(3)使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C 甘油
(4)方案一:将少量NaHCO3粉末放入一支洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸;方案二:把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成
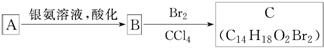
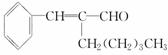
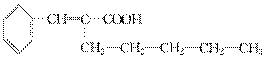

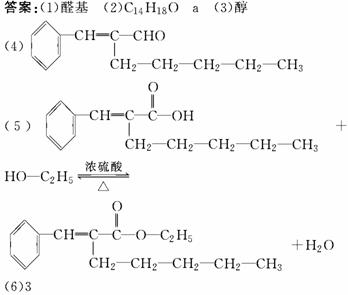
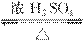
 解析:甲醛、乙醛、丙醛还原产物没有同分异构体。
解析:甲醛、乙醛、丙醛还原产物没有同分异构体。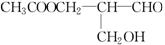 美国科学家威廉·诺尔斯、柏林·沙普利斯和日本化学家野依良治因通过使用快速和可控的重要化学反应来合成某些手性分子的方法而获得2001年的诺贝尔化学奖。所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手 性分子,中心碳原子为手性碳原子。凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物
有光学活性。则该有机化合物分别发生如下
美国科学家威廉·诺尔斯、柏林·沙普利斯和日本化学家野依良治因通过使用快速和可控的重要化学反应来合成某些手性分子的方法而获得2001年的诺贝尔化学奖。所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手 性分子,中心碳原子为手性碳原子。凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物
有光学活性。则该有机化合物分别发生如下 解析:因1
mol一元醛通常可以得到2
mol Ag,现得到0.4
mol Ag,故醛为0.2
mol,该醛式量为3/0.2=15。此题似乎无解,但1
mol甲醛可以得到4
mol Ag,即3 g(0.1 mol)甲醛可得到43.2 g(0.4
mol)Ag。
解析:因1
mol一元醛通常可以得到2
mol Ag,现得到0.4
mol Ag,故醛为0.2
mol,该醛式量为3/0.2=15。此题似乎无解,但1
mol甲醛可以得到4
mol Ag,即3 g(0.1 mol)甲醛可得到43.2 g(0.4
mol)Ag。