13.用中和滴定法测定某烧碱的纯度。
(1)配制待测液
将1.7 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要
仪器有________________________________。
(2)滴定
①盛装0.20 mol·L-1盐酸标准液应该用________式滴定管,盛装前对滴定管的要求是:
______________。
②滴定时,应先向锥形瓶中加________滴________作指示剂;滴定过程中两眼应注视
__________________;当____________________时为滴定终点。
③有关数据记录如下:
|
滴定序号 |
待测液体体积(mL) |
|
|
|
所消耗盐酸标准液的体积(mL) |
|
|
|
|
滴定前 |
滴定后 |
|
|
|
1 |
20.00 |
0.50 |
20.70 |
|
2 |
20.00 |
6.00 |
26.00 |
(3)纯度计算:NaOH溶液的浓度为________ mol·L-1,烧碱样品的纯度为________。
(4)对几种假定情况的讨论:
①若用蒸馏水冲洗锥形瓶,则会使测定结果________;
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果________;
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果________;
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果________。
解析:这是一考查学生的溶液配制、中和滴定操作等综合能力的题目。解此题时应以操
作为主线,以c(待测)为前提,联想每步操作中所用仪器及操作不当所引起的
误差。
答案:(1)烧杯、玻璃棒、200 mL容量瓶、胶头滴管
(2)①酸 用蒸馏水洗净后,还需用标准溶液润洗2-3次 ②2-3 甲基橙 锥形瓶内
溶液颜色变化 滴入最后一滴,溶液的颜色突变为橙色且半分钟内不褪色
(3)0.201 94.6% (4)①无影响 ②偏高 ③偏低 ④偏低
9.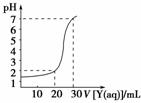 如右图为对10 mL一定物质的量浓度的盐酸X用一定物质的量
如右图为对10 mL一定物质的量浓度的盐酸X用一定物质的量
浓度的NaOH溶液Y滴定的图象,依据图象推出X和Y的物质
的量浓度是下表内各组中的 ( )
|
选项 |
A |
B |
C |
D |
|
X/(mol·L-1) |
0.12 |
0.04 |
0.03 |
0.09 |
|
Y/(mol·L-1) |
0.04 |
0.12 |
0.09 |
0.03 |
解析:由题图象:c(HCl)·V(HCl)=c(NaOH)·V(NaOH),==
=,由表中知A、D属此种情况。但A组中,X=0.12 mol/L,c(H+)=0.12 mol/L,
pH<1,不符合图象;D组X=0.09 mol/L,pH>1,加入20 mL NaOH后溶液的pH
为: c(H+)==10-2 mol/L,pH=-lg10-2=
 CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中
CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中 答案:D
答案:D