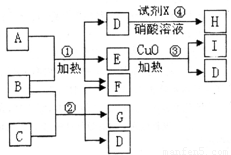
摘要:3.现有五种1-20号元素组成A-I纯净物.转化关系如图所示: 相关信息有: (a)反应④的现象是有白色沉淀生成.且H的相对分子质量为143.5, (b)在常温下.A.I都是气态单质.且A的水溶液具有漂白性.I的一种同素异形体具有比I更强的氧 化性, (c)除反应③外.其他反应都在水中进行.1 mol B含28 mol电子, (d)C是由第三周期的两种元素组成MZ3型化合物. (1)试剂X的名称为 . (2)写出反应③的化学方程式: ,写出反应①的离子方程式: . (3)用离子方程式表示C溶液呈酸性的原因: . (4)向G的水溶液中通入过量的二氧化碳.写出离子方程式: . 易错分析:因对O3的性质不熟而不能利用“I的一种同素异形体具有比I更强的氧化性 这一条件推 出I为O2.同时易忽视氧化铜作氯酸钾分解反应的催化剂.氯气与KOH在加热条件下反应等盲点知 识.无法正确推断.误认为E为次氯酸钾.导致其他推断错误. 解析:除X.H外.其余物质只含1-20号元素中的五种元素.暗示可能含钾或钙.由信息(a)知.H 为氯化银(M=143.5 g/mol).X为硝酸银溶液.推知D中含有氯离子,由信息(b)知.A为氯气.I为氧 气.联系高一化学“氧化铜作氯酸钾分解反应的催化剂 .E可能是氯酸钾.D可能是氯化钾,B为 强碱.若B为KOH,1 mol KOH含28 mol电子.符合信息(c).所以.B为KOH.D为KCl.E为KClO3. 再由信息(d)推知.C为氯化铝.G为偏铝酸钾.有关化学反应方程式:反应①3Cl2+6KOH5KCl +KClO3+3H2O,反应②为AlCl3+4KOH===KAlO2+3KCl+2H2O,反应④为KCl+AgNO3===AgCl↓ +KNO3.因为氢氧化铝不溶于弱酸.在偏铝酸钾溶液中通入过量的二氧化碳生成氢氧化铝 和碳酸氢钾:KAlO2+CO2+2H2O===KHCO3+Al(OH)3↓. 答案:2KClO3CuO△2KCl+3O2↑ 3Cl2+6OH-5Cl-+ClO3-+3H2O (3)Al3++3H2OAl(OH)3+3H+ (4)AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-
网址:http://m.1010jiajiao.com/timu3_id_81965[举报]
 现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下
现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下相关信息有;①反应④产生白色沉淀,且M(H):143.5g/mol;
②常温下,A、I都是气态单质,且A和I的一种同素异形体都能使湿润的有色布条褪色且都能用于饮用水消毒.
③1molB含28mole-,反应③属于分解反应.
④C是由第三周期的两种元素组成原子个数比为1:3型化合物.
(1)B的电子式为


硝酸银溶液
硝酸银溶液
.反应②离子方程式:4OH-+Al3+=AlO2-+2H2O
4OH-+Al3+=AlO2-+2H2O
.(2)写出反应③的化学方程式:
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
;上述所有物质形成的晶体类型有
| ||
| △ |
分子晶体、离子晶体
分子晶体、离子晶体
(选填:分子晶体、离子晶体、原子晶体)(3)C溶液中阴离子浓度与阳离子浓度之比
大于
大于
3(填:大于、小于或等于);简述实验室用C晶体配制3mol/L的C溶液的操作方法是取一定量氯化铝晶体溶于一定量较浓的盐酸中,加蒸馏水稀释至3mol/L的氯化铝溶液
取一定量氯化铝晶体溶于一定量较浓的盐酸中,加蒸馏水稀释至3mol/L的氯化铝溶液
.(4)写出G与C溶液混合的离子方程式
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.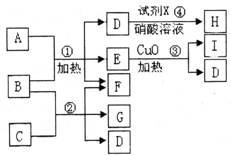 现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下
现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下
相关信息有;①反应④产生白色沉淀,且M(H):143.5g/mol;
②常温下,A、I都是气态单质,且A和I的一种同素异形体都能使湿润的有色布条褪色且都能用于饮用水消毒.
③1molB含28mole-,反应③属于分解反应.
④C是由第三周期的两种元素组成原子个数比为1:3型化合物.
(1)B的电子式为______.试剂X的名称为______.反应②离子方程式:______.
(2)写出反应③的化学方程式:______;上述所有物质形成的晶体类型有______ (选填:分子晶体、离子晶体、原子晶体)
(3)C溶液中阴离子浓度与阳离子浓度之比______3(填:大于、小于或等于);简述实验室用C晶体配制3mol/L的C溶液的操作方法是______.
(4)写出G与C溶液混合的离子方程式______.
查看习题详情和答案>>
现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下
相关信息有;①反应④产生白色沉淀,且M(H):143.5g/mol;
②常温下,A、I都是气态单质,且A和I的一种同素异形体都能使湿润的有色布条褪色且都能用于饮用水消毒.
③1molB含28mole-,反应③属于分解反应.
④C是由第三周期的两种元素组成原子个数比为1:3型化合物.
(1)B的电子式为______.试剂X的名称为______.反应②离子方程式:______.
(2)写出反应③的化学方程式:______;上述所有物质形成的晶体类型有______ (选填:分子晶体、离子晶体、原子晶体)
(3)C溶液中阴离子浓度与阳离子浓度之比______3(填:大于、小于或等于);简述实验室用C晶体配制3mol/L的C溶液的操作方法是______.
(4)写出G与C溶液混合的离子方程式______.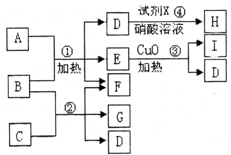
查看习题详情和答案>>
相关信息有;①反应④产生白色沉淀,且M(H):143.5g/mol;
②常温下,A、I都是气态单质,且A和I的一种同素异形体都能使湿润的有色布条褪色且都能用于饮用水消毒.
③1molB含28mole-,反应③属于分解反应.
④C是由第三周期的两种元素组成原子个数比为1:3型化合物.
(1)B的电子式为______.试剂X的名称为______.反应②离子方程式:______.
(2)写出反应③的化学方程式:______;上述所有物质形成的晶体类型有______ (选填:分子晶体、离子晶体、原子晶体)
(3)C溶液中阴离子浓度与阳离子浓度之比______3(填:大于、小于或等于);简述实验室用C晶体配制3mol/L的C溶液的操作方法是______.
(4)写出G与C溶液混合的离子方程式______.