7.X、Y、Z、W四种元素在元素周期表中的相对位置如图所示,Y、Z的质子数之和为21,下列说法正确的是( )
|
|
X |
|
Y |
|
Z |
|
W |
|
A.常压下,四种元素的单质中,W单质的熔点最高
B.Z的阳离子与Y的阴离子电子层结构相同
C.X的气态氢化物比Y的气态氢化物稳定
D.W元素的金属性比Z元素的金属性强
解析:选B。Y、Z的质子数之和为21,再根据题图,可知Y、Z都应是短周期元素,则它们的原子序数差为5,由此推出Y是O,Z是Al,则X、W分别为C、P。四种单质中碳(X)单质的熔点最高,A错;C、O同周期,O的非金属性比C强,所以H2O比CH4稳定,C错;Al是金属,而磷是非金属,所以D错。
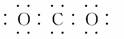

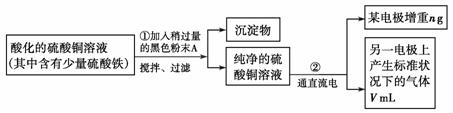
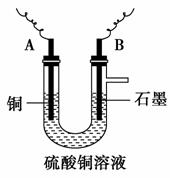
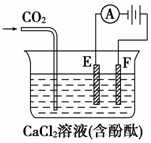 (8分)右图为持续电解饱和CaCl2水溶液的装置(以铂为电极,Ⓐ为电流表)。电解一段时间t1后(溶液中氯离子完全电解),将CO2连续通入电解液中,请回答有关问题。
(8分)右图为持续电解饱和CaCl2水溶液的装置(以铂为电极,Ⓐ为电流表)。电解一段时间t1后(溶液中氯离子完全电解),将CO2连续通入电解液中,请回答有关问题。