11.(2010年重庆模拟)碳酸氢钠是一种在生产、生活实际中有着重要用途的化合物。某课外兴趣活动小组的同学进行了以下的实验活动。
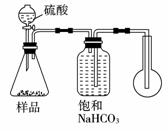
(1)甲同学用如右图所示的装置进行工业纯碱样品(含少量氯化钠等不与酸反应的杂质)中碳酸钠质量分数的测定。广口瓶中用碳酸氢钠饱和溶液而不用水。用饱和碳酸氢钠溶液的优点是____________,请解释原因____________ 。
(2)乙同学给10 ℃的NaHCO3饱和溶液加热,测得该溶液的pH发生了如下的变化。请回答下列问题:
|
温度/℃ |
10 |
20 |
30 |
加热煮沸后,冷却到时50 ℃ |
|
PH |
8.3 |
8.4 |
8.5 |
8.8 |
①乙同学测定溶液的pH可选用____________(填序号)。
A.常用pH试纸 B.pH计(酸度计)
C.酚酞试液 D.甲基橙试液
②乙同学认为产生上述现象的原因有两种可能。预测之一是:加热时NaHCO3受热分解生成了Na2CO3;预测二是:____________ 。
③查阅资料发现:NaHCO3的分解温度为150 ℃,由此判断,乙同学对第一种情况的预测是____________(填“正确”或“不正确”)。请你设计实验验证预测二是否正确____________ 。
(3)丙同学认为:在饱和的NaHCO3溶液中,Na+、H+、HCO3-、CO32-、OH-的离子浓度存在大小关系和等量关系。
①以上5种离子浓度由大到小的顺序是____________ 。
②[Na]++[H+]=____________ 。
 2SO3。
2SO3。 ①图象中平衡常数K(A)____________K(B)(填“大于”或“等于”或“小于”),反应的ΔH____________0(填“大于”或“等于”或“小于”)。
①图象中平衡常数K(A)____________K(B)(填“大于”或“等于”或“小于”),反应的ΔH____________0(填“大于”或“等于”或“小于”)。