网址:http://m.1010jiajiao.com/timu3_id_72801[举报]
回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)若大烧杯上不盖硬纸板,求得的中和热数值会(填“偏大”“偏小”或“无影响”) 。
(4)实验中改用60 mL 0.50 mol· L-1盐酸与50 mL 0.55 mol· L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”) ,所求中和热(填“相等”或“不相等”) ,理由是 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”“偏小”或“无影响”) 。
查看习题详情和答案>>
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是____________________________。
(2)烧杯间填满碎纸条的作用是__________________________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值______________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量______________(填“相等”或“不相等”),所求中和热______________(填“相等”“不相等”),简述理由_____________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会______________;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会______________。(均填“偏大”“偏小”或“无影响”)
查看习题详情和答案>>
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___________________________________。
(2)烧杯间填满碎纸条的作用是______________________________________________。
(3)若大烧杯上不盖硬纸板,求得中和热数值____________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 ____________(填“相等”或“不相等”),所求中和热____________(填“相等”或“不相等”),简述理由________________________________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会____________;用0.50 mol·L-1 NaOH溶液50 mL进行上述实验,测得的中和热的数值会____________(填“偏大”“偏小”或“无影响”)。
查看习题详情和答案>>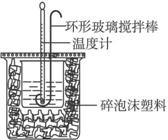
中和热的测定
(1)烧杯间填满碎泡沫塑料的作用是_______________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值_____________。(填“偏大”“偏小”或“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量_____________(填“相等”“不相等”),所求中和热_____________(填“相等”“不相等”),简述理由:____________________________________________________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____________(填“偏大”“偏小”“无影响”)。
查看习题详情和答案>>
图1-1
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________。
(2)烧杯间填满碎纸条的作用是____________________________。
(3)若大烧杯上不盖硬纸板,求得中和热数值______________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1溶液进行反应,与上述实验相比,所放出的热量______________(填“相等”或“不相等”),所求中和热______________(填“相等”或“不相等”),简述理由__________________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会_______;用0.50 mol·L-1NaOH溶液50 mL进行上述实验,测得的中和热的数值会______________(填“偏大”“偏小”或“无影响”)。
查看习题详情和答案>>