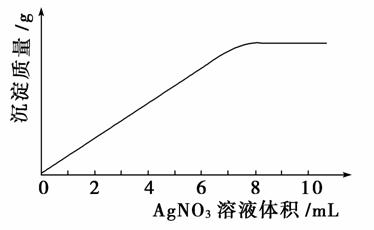
15.(2009年高考台湾卷)下表所列为五种可溶性盐在30 ℃的溶解度(g/100 g H2O):
|
盐 |
NaCl |
NaHCO3 |
Na2CO3 |
(NH4)2CO3 |
NH4Cl |
|
溶解度 |
36.5 |
12.1 |
30.0 |
27.0 |
41.1 |
若在30 ℃的饱和食盐水中通入氨气至饱和后,再通入二氧化碳就会有晶体析出。试参考表中的数据,推测析出的晶体是下列的哪一种( )
A.NaCl B.NaHCO3
C.Na2CO3 D.(NH4)2CO3
E.NH4Cl
解析:选B。食盐水中通入氨气,再通入CO2后,溶液中应含Na+、Cl-、NH4+、CO32-、HCO3-。各盐类的溶解度大小为:NH4Cl>NaCl>Na2CO3>(NH4)2CO3>NaHCO3,其中Na+、HCO3-会先形成NaHCO3结晶析出。