21.(10分)归纳整理是科学学习的重要方法之一。在学习了卤族元素的各种性质后,可归纳整理出如下所示的表格(部分)。
|
性质 元素 |
9F |
17Cl |
35Br |
53I |
|
|
||||
|
单质熔点(℃) |
-219.6 |
-101 |
|
113.5 |
|
单质沸点(℃) |
-188.1 |
-34.6 |
58.78 |
184.4 |
|
主要化合价 |
-1 |
-1,+1, +3,+5, +7 |
-1,+1, +3,+5, +7 |
|
|
原子半径 |
 逐渐增大 逐渐增大 |
|||
|
单质与H2反应情况 |
暗处剧 烈化合 并爆炸 |
光照或 点燃反 应 |
加热至 一定温 度反应 |
不断加热才缓 慢反应 |
请根据表回答下列问题:
(1)溴的熔点范围可能是__________。
(2)碘的化合价可能有___________________________________。
(3)氯、溴、碘的最高价氧化物对应水化物的酸性由强至弱顺序是________________________(填化学式)。(4)氢碘酸有较强的____________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_________________________。
(5)已知在常温下,H2和I2反应生成256 g HI放出14.9 kJ的热量,试写出HI分解的热化学方程式_______________________________。
解析:(1)溴的熔点应该介于Cl2和I2之间,但物质的熔点应低于沸点。
(2)碘元素具有跟氯、溴相似的化学性质,主要化合价应该有-1,+1,+3,+5,+7。
(3)氯、溴、碘的最高价氧化物对应水化物的酸性由强到弱的顺序为HClO4>HBrO4>HIO4。
(4)氢碘酸应该具有较强的还原性,易被空气中的氧气氧化而变质。
(5)H2和I2反应放热,则HI分解需吸收热量,热化学方程式为2HI(g)H2(g)+I2(g) ΔH=+14.9 kJ·mol-1
答案:(1)-101 ℃-58.78 ℃
(2)-1,+1,+3,+5,+7
(3)HClO4>HBrO4>HIO4
(4)还原性 4HI+O2===2I2+2H2O
(5)2HI(g)H2(g)+I2(g) ΔH=+14.9 kJ·mol-1
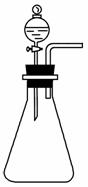 如右图所示实验室制气装置,现提供下列试剂:①浓硫酸;②浓盐酸;③食盐;④二氧化锰;⑤过氧化氢;⑥浓氨水;⑦生石灰。利用以上试剂和该制气装置,不能快速制取的气体是( )
如右图所示实验室制气装置,现提供下列试剂:①浓硫酸;②浓盐酸;③食盐;④二氧化锰;⑤过氧化氢;⑥浓氨水;⑦生石灰。利用以上试剂和该制气装置,不能快速制取的气体是( )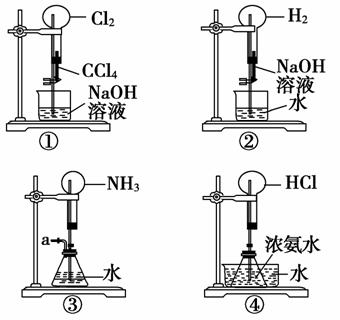
 HCl+HClO,加入NaOH溶液后,该平衡被破坏,氯气逐渐被消耗,所以氯水黄绿色消失,这个可逆反应是氧化还原反应;FeCl3溶液与铁粉发生氧化还原反应,生成颜色很浅的Fe2+;二氧化硫使品红溶液褪色是二氧化硫与有色物质结合生成不稳定的无色物质;Na2CO3水解,所以溶液显碱性,滴入酚酞变红;葡萄糖具有还原性,能够在加热的条件下将新制Cu(OH)2还原为红色的Cu2O。
HCl+HClO,加入NaOH溶液后,该平衡被破坏,氯气逐渐被消耗,所以氯水黄绿色消失,这个可逆反应是氧化还原反应;FeCl3溶液与铁粉发生氧化还原反应,生成颜色很浅的Fe2+;二氧化硫使品红溶液褪色是二氧化硫与有色物质结合生成不稳定的无色物质;Na2CO3水解,所以溶液显碱性,滴入酚酞变红;葡萄糖具有还原性,能够在加热的条件下将新制Cu(OH)2还原为红色的Cu2O。