0 43240 43248 43254 43258 43264 43266 43270 43276 43278 43284 43290 43294 43296 43300 43306 43308 43314 43318 43320 43324 43326 43330 43332 43334 43335 43336 43338 43339 43340 43342 43344 43348 43350 43354 43356 43360 43366 43368 43374 43378 43380 43384 43390 43396 43398 43404 43408 43410 43416 43420 43426 43434 447348
 已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶各收集满NH3和HCl气体,实验后二个烧瓶内溶液的关系是(两烧瓶内充满溶液且不考虑溶质的扩散)( )
已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶各收集满NH3和HCl气体,实验后二个烧瓶内溶液的关系是(两烧瓶内充满溶液且不考虑溶质的扩散)( )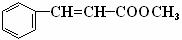 (14分)(1)肉桂酸甲酯 (
) 常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
(14分)(1)肉桂酸甲酯 (
) 常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。 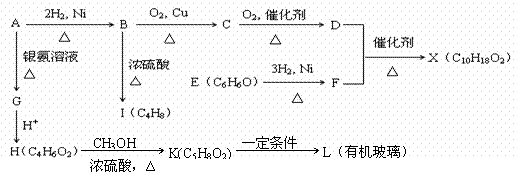 溶液作用显紫色。
溶液作用显紫色。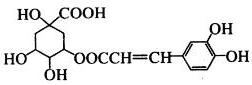
 2NH3(g);△H=-Q kJ·mol-1(Q>0)。现有甲乙两个相同的密闭容器,向甲容器中充入1mol N2(g)和3mol H2(g),在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol NH3(g),达到平衡时吸收的热量为Q2 kJ。已知Q2=3Q1,下列叙述中正确的是
2NH3(g);△H=-Q kJ·mol-1(Q>0)。现有甲乙两个相同的密闭容器,向甲容器中充入1mol N2(g)和3mol H2(g),在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol NH3(g),达到平衡时吸收的热量为Q2 kJ。已知Q2=3Q1,下列叙述中正确的是