摘要:7. 碘被称为“智力元素 .科学合理地补碘可防止碘缺乏症.碘酸钾(KIO3)是国家规定的食盐加碘剂.它的晶体为白色.可溶于水.以碘为原料.通过电解可以制备碘酸钾.电解前.先将一定量的精制碘溶于过量氢氧化钾溶液.溶解时发生反应:3I2 + 6KOH = 5KI + KIO3 + 3H2O.将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区.电解槽用水冷却.以下有关该实验的说法错误的是: A. 碘是紫黑色固体物质.实验室常用升华法来分离提纯含有少量杂质的固体碘 B. 电解时.阳极上发生反应的电极反应式为I- + 6OH- -6e- = IO3- + 3H2O C. 通过离子交换膜的K+离子的运动方向是从右向左 D. 当有3mol电子发生转移时.其中被还原生成的KIO3的物质的量为0.5mol
网址:http://m.1010jiajiao.com/timu3_id_433058[举报]
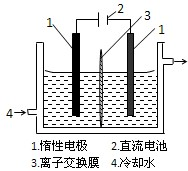 碘被称为“智力元素”,科学合理地补碘可防止碘缺乏症.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.以碘为原料,通过电解可以制备碘酸钾.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却(实验装置如右图所示).以下有关该实验的说法错误的是( )
碘被称为“智力元素”,科学合理地补碘可防止碘缺乏症.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.以碘为原料,通过电解可以制备碘酸钾.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却(实验装置如右图所示).以下有关该实验的说法错误的是( )
查看习题详情和答案>>
碘被称为“智力元素”,科学合理地补碘可防止碘缺乏症.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.以碘为原料,通过电解可以制备碘酸钾.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却(实验装置如右图所示).以下有关该实验的说法错误的是( )

查看习题详情和答案>>
| A.碘是紫黑色固体物质,实验室常用升华法来分离提纯含有少量杂质的固体碘 |
| B.电解时,阳极上发生反应的电极反应式为I-+6OH--6e-=IO3-+3H2O |
| C.通过离子交换膜的K+离子的运动方向是从右向左 |
| D.当有3mol电子发生转移时,其中被还原生成的KIO3的物质的量为0.5mol |

(1).
下列有关电化学的图示中,完全正确的是________
(2).
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中可与碘化物作用生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.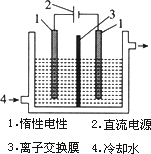
请回答下列问题:
a.碘是________(填颜色)固体物质,实验室常用________方法来分离提纯含有少量泥沙杂质的固体碘.
b.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH![]() 5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.
5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.
电解时,阳极上发生反应的电极反应式为________,每生成1 mol KIO3,电路中通过的电子的物质的量为________.
c.电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请设计一个检验电解液中是否有I-的简单实验方案,并按要求填写下表.
![]()
可供选择的试剂有淀粉溶液,稀硫酸,氯化钠溶液,酒精等.(用其中的一种或多种均可.)
d.电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
阳极电解液→①蒸发浓缩→②→③过滤→④洗涤→⑤→碘酸钾晶体
步骤②的操作名称是________,步骤⑤的操作名称是________.步骤④洗涤晶体的目的是________.
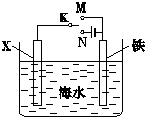 (1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
(1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于N
N
处.若X为锌,开关K置于M处,该电化学防护法称为牺牲阳极的阴极保护法
牺牲阳极的阴极保护法
.(2)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,通入肼的一极为
负
负
极,该极的电极反应式是N2H4+4OH--4e-=N2↑+4H2O
N2H4+4OH--4e-=N2↑+4H2O
,电池工作一段时间后,电解质溶液的pH将减小
减小
(填“增大”、“减小”、“不变”).(3)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,可通过电解制备碘酸钾.(阴、阳两极均用惰性电极,阴极室与阳极室用阳离子交换膜隔开)请回答下列问题:
①电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.电解时,阳极上发生反应的电极反应式为
2I--2e-=I2
2I--2e-=I2
.②电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表.
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选.
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸.
| 实验方法 | 实验现象及结论 |
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如1图所示.请回答下列问题:
(1)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.
电解时,阳极上发生反应的电极反应式为
(2)电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请写出检验电解液中是否有I-所需的实验药品:
(3)电解完毕,从电解液中得到碘酸钾晶体的实验过程如图2:步骤②的操作名称是
查看习题详情和答案>>
(1)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.

电解时,阳极上发生反应的电极反应式为
2I--2e-=I2
2I--2e-=I2
;阴极上观察到的实验现象是有气泡产生
有气泡产生
.(2)电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请写出检验电解液中是否有I-所需的实验药品:
氯气、淀粉试液
氯气、淀粉试液
.(3)电解完毕,从电解液中得到碘酸钾晶体的实验过程如图2:步骤②的操作名称是
冷却结晶
冷却结晶
,步骤⑤的操作名称是干燥
干燥
.步骤④洗涤晶体的目的是洗去吸附在碘酸钾晶体上的氢氧化钾等杂质
洗去吸附在碘酸钾晶体上的氢氧化钾等杂质
.