(二)若A、C、E是氢化物,构成B和F的元素是第三周期的相邻元素,F是一种淡黄色固体单质,A能使湿润的红色石蕊试纸变蓝,A、E混合时有白烟生成。
(1)写出D的分子式 。
(2)由A或C转化为E,每消耗lmolB,转移电子的物质的量为 mol。
(3)同温同压下,将V1L A气体V2L E气体通入水中,
①若V1= V2,反应后溶液的pH 7(填“>”或“<”或“=”),原因是
(用离子方程式表示)。
②若所得溶液的pH=7,则V1 V2 (填“>”或“<”或“=”)。
19.(14分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广
泛的开发和应用前景。
(1):工业上一般采用下列两种反应合成甲醇:

①上述反应符合“原子经济”原则的是 (填“I”或“II”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
|
温度 |
250 |
300 |
350 |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断△H1 0(填“>”、“=”或“<”)。
③某温度下,将2molCO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表
中选择)。 .
(2)已知在常温常压下:
①2CH30H(1)+302(g)== 2C02(g)+4H20(g) △H =-1275.6 kJ/mol
②2CO(g)+02(g)==2C02(g) △H =-566.0 kJ/mol
③H20(g)==H20(1) △H =-44.0 kJ/mol ,
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。
用此电池电解饱和的NaCI溶液(惰性电极),当阳极产生标准状况下的C12为40.32L时,电池中消耗的甲醇最少为 g。

15.(8分)以硼氢化合物NaBH4和过氧化氢作为燃料的燃料电池是由美国伊利诺斯州立大学Miley教授在2007年设计的,可用作空军通信卫星电源。
(1)下列化学反应通过设计一种装置可实现化学能直接转化为电能的是--(填序号)。
A.NaOH+HCl==NaCl+H20 △H<O
B.C02+C==2CO △H>0
C.CH4+202+2NaOH==Na2C03+3H20 △H<O
D.2Al+2NaOH+2H20=2NaAl02+3H2↑ △H<0
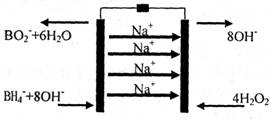 (2) 一种NaBH4/H202燃料电池的结构如下图所示,负极材料采用Pt/C,正极材料采用Mn02,电解质膜为Nafion膜。 .
(2) 一种NaBH4/H202燃料电池的结构如下图所示,负极材料采用Pt/C,正极材料采用Mn02,电解质膜为Nafion膜。 .
①依据图示判断电池右边是 (填“正极”或“负极”)
②下列有关该电池的说法正确的是 (填序号)。
A.铂和二氧化锰既作电极材料,又可能起催化作用
B.该电池所处的温度不宜过高
C.该电池的正极发生氧化反应
D.在电池反应中,每消耗1L6mol/LH202溶液,理论上流过电路中的电子为6NA个
 ③该电池的负极反应为
。
③该电池的负极反应为
。
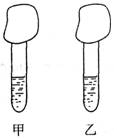
16.(12分)某研究性学习小组用如右图所示的简易装置证明同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带(设两条镁带完全相同)反应时,生成氢气的速率不同。该实验的主要操作步骤如下:
①配制浓度均为0.1mol/L的HA、HB溶液;
②量取10.00mL0.1mol/L的HA、HB溶液分别加入到甲、乙两支试 管中;
③分别称取除去表面氧化膜的镁带置于气球中,并将气球套于管口;
④同时拉伸气球,使镁带落于酸液中。反应起始时,甲中气球迅速鼓起,而乙中气球缓慢鼓起。请回答下列问题:
(1)本实验中量取酸液时应选用的仪器是 ;
(2)反应结束时,两气球体积人小为 (填“基本相同”、“甲中大”或“乙中大”);
(3)由④中现象可得出的结论是 ;
(4)若将10.00mL0.1mol/L的HA、HB溶液换成10.00mL的pH=l的HA、HB溶液重做实验(镁足量),则反应结束后, (选填“甲”或“乙”)中球较大,其理由是
:
(5)根据上述实验结论,判断含物质的量浓度均为0.1mol/L的HA和HB混合溶液中离子浓度大小关系正确的是 。
A.c(A-)>c(B-)c(OH-)>c(H+)>c(HB)>c(HA)
B.c(H+)>c(OH-)>c(HA)>c(HB)>c(B-)>c(A-)
C.c(H+)=c(OH-)+c(A-)+c(B-)
D.c(A-)+c(HA)=c(B-)+c(HB)
17.(14分)李明同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究。
[实验一]探究浓硫酸的氧化性
 将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装
置省略)
(1)该装置设计上存在明显缺陷,请指出: 。
(2)选择试剂写出装置甲中反应的化学方程式 。
(3)装置乙中的试剂是 。
[实验二]探究硫酸亚铁同体是否变质
(4)请你帮助李明同学完成如下实验方案:
|
实验操作 |
预期现象和结论 |
|
① |
② |
[实验三] KHS04制取H202并测其质量分数
查阅资料得知:工业上用电解KHS04饱和溶液制取H202,示意图如下。

李明用此法制取一定浓度的H202,并进行下列实验测定H2O2的质量分数:
①取5.00mL H202溶液(密度为1.00g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
②用0.1000mol/L KMn04溶液滴定:
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL。 回答下列问题:
(5)已知上述滴定过程中反应的离子方科式为2Mn04-+5H2O2+6H+==2Mn2++8H2O+5O2↑。
滴定终点的判断标志是: 。
(6)原H2O2溶液中溶质的质量分数为 。
18.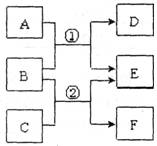 (10分)A-F是中学常见物质,其中B、D、F均为单质,它们的相互转化关系如下图所示:
(10分)A-F是中学常见物质,其中B、D、F均为单质,它们的相互转化关系如下图所示:
 反应过程中,当其他条件不变时,C的
反应过程中,当其他条件不变时,C的 D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 12. 已知盐酸阿比朵尔的结构简式见下图,下列有关它的说法不正确的是
12. 已知盐酸阿比朵尔的结构简式见下图,下列有关它的说法不正确的是