0 43118 43126 43132 43136 43142 43144 43148 43154 43156 43162 43168 43172 43174 43178 43184 43186 43192 43196 43198 43202 43204 43208 43210 43212 43213 43214 43216 43217 43218 43220 43222 43226 43228 43232 43234 43238 43244 43246 43252 43256 43258 43262 43268 43274 43276 43282 43286 43288 43294 43298 43304 43312 447348
 2HNO3+4N2↑+9H2O中,每生成4molN2,转移电子数为15NA
2HNO3+4N2↑+9H2O中,每生成4molN2,转移电子数为15NA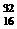 S
S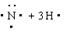


 >
>
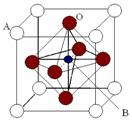 (7)某种钙钛型复合氧化物(如下图),这种化合物也具有巨磁电阻效应。
(7)某种钙钛型复合氧化物(如下图),这种化合物也具有巨磁电阻效应。
 (20分)
(20分)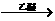 RMgX(Grignard试剂)
RMgX(Grignard试剂)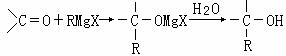
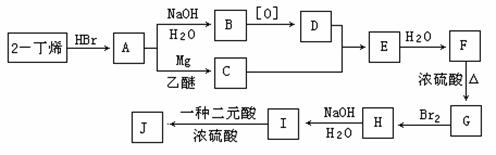
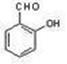
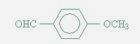
 (5)以乙烯和必要的无机物为原料合成2-丁醇。请写出合成路线(用合成路线流程图表示。)如
CH3CH2OH
(5)以乙烯和必要的无机物为原料合成2-丁醇。请写出合成路线(用合成路线流程图表示。)如
CH3CH2OH  CH2=CH2
CH2=CH2 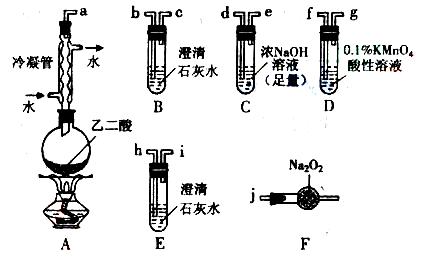
 反应。
反应。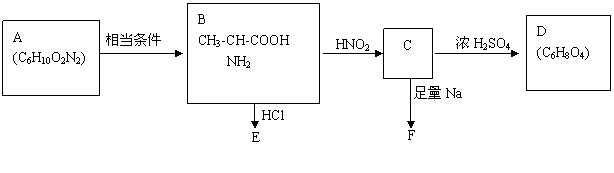 根据下图判断和回答问题:
根据下图判断和回答问题:

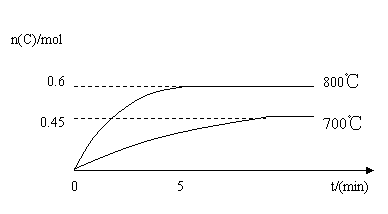 13(8分)在容积为2L的密闭容器中,进行反应:A(s)+2B(g)
C(g)+D(g)在不同温度下,C的物质的量n(C)和时间t的关系如图所示。试回答下列问题:
13(8分)在容积为2L的密闭容器中,进行反应:A(s)+2B(g)
C(g)+D(g)在不同温度下,C的物质的量n(C)和时间t的关系如图所示。试回答下列问题: