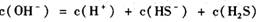21. (12分)
2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(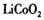 )、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
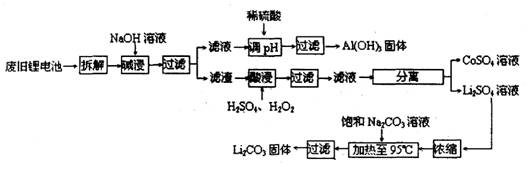
(1)上述工艺回收到的产物有______________________________________________
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_________________________________________________
(3)碱浸时主要反应的离子方程式为_____________________________ 。
(4)酸浸时反应的化学方程式为___________________________________ 。最后一步过滤应__________
(5)如何洗涤过滤后的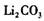 固体________________________________________________
固体________________________________________________
22(10 分)
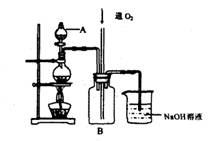
硫酸铜是一种用途广泛的化工原料。将适量稀硝酸分多次加人到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶,得到硫酸铜晶体(装置如图所示)。
(1)图中烧瓶内发生的离子反应方程式为:_____
(2)反应时B瓶内的现象是 _____________________
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
把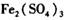 作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节
作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节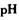 ,产生
,产生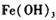 沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使
沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使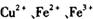 分别生成沉淀的pH如下:
分别生成沉淀的pH如下:
 请回答下列问题:
请回答下列问题:
①物质甲 是_____ (填字母序号)。
a. 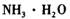 b.
b.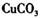 c.
c.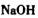 d.
d.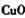
②该方案中调节PH的范围是_______ 。
第二组:过氧化氢氧化法
|
物质 |
开始沉淀时的PH |
完全沉淀时的PH |
|
Fe(OH)3 |
1.9 |
3. 2 |
|
Cu(OH)2 |
4. 7 |
6. 7 |
|
Fe(OH)2 |
6. 3 |
9. 7 |
将铜丝放到稀硫酸中,加入10%的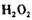 ,微热。充分反应后,经过滤、蒸发结晶、抽滤等操作,用少量95%的酒精淋洗后晾干,得到硫酸铜晶体。
请回答下列问题:
,微热。充分反应后,经过滤、蒸发结晶、抽滤等操作,用少量95%的酒精淋洗后晾干,得到硫酸铜晶体。
请回答下列问题:
③加热时温度不宜过高的原因是 _____,晶体采用酒精淋洗的优点是_____ 。
18. 多硫化钠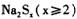 在
在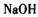 溶液中可被
溶液中可被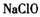 氧化成
氧化成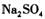 ,而
,而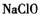 被还原成
被还原成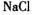 ,反应中
,反应中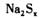 与
与 的物质的量之比为1:16。
的物质的量之比为1:16。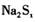 在结构上与
在结构上与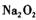 相似。则下列有关说法正确的是
相似。则下列有关说法正确的是
A.
该反应中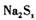 是氧化剂,
是氧化剂, 是还原剂
是还原剂
B.
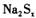 含有离子键和极性共价键
含有离子键和极性共价键
C.
 参加反应,有32mol电子转移
参加反应,有32mol电子转移
D.
 中的X数值为2
中的X数值为2
第II卷非选择题(56分)
|
19.
(12 分) 有关元素X、Y、Z、W的信息如下:
|
请回答下列问题:
(1) Y的单质在空气中充分燃烧所得氧化物的电子式_________________
(2) X、Y、W的简单离子的半径由大到小的是________________ (写离子符号)
(3) 向淀粉碘化钾溶液中滴加几滴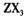 的浓溶液,现象为_______________ ,
的浓溶液,现象为_______________ ,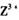 基态离子的电子排布式为
基态离子的电子排布式为
(4) 以 溶液为原料制取无水
溶液为原料制取无水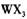 ,主要操作包括加热浓缩、冷却结晶、过滤,先制得
,主要操作包括加热浓缩、冷却结晶、过滤,先制得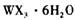 晶体,然后在 条件下加热
晶体,然后在 条件下加热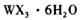 晶体,能进一步制取无水
晶体,能进一步制取无水 .其原因是(结合离子方程式简要说明) _____________________________________________
.其原因是(结合离子方程式简要说明) _____________________________________________
 键和一个
键和一个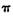 键
键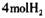 发生加成反应
发生加成反应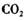 气体
(2)已知R物质是乙基香兰素的同分异构体,其性质如下:
气体
(2)已知R物质是乙基香兰素的同分异构体,其性质如下: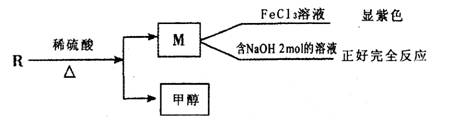
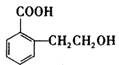 可以通过不同的反应制得下列物质。
可以通过不同的反应制得下列物质。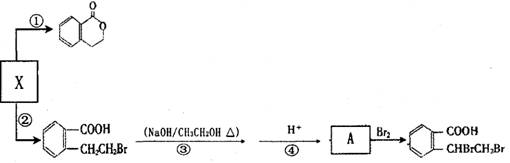
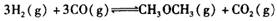
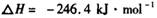
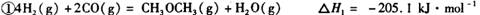
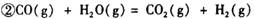
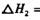 :__________________ ______________
:__________________ ______________ 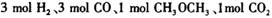 ,在一定温度和压强下发生反应:
,在一定温度和压强下发生反应: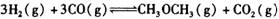 ,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:①反应开始时正、逆反应速率的大小:V(正)____V(逆)(填“ >”、“ < ”或"="),理由是:________________________________
,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:①反应开始时正、逆反应速率的大小:V(正)____V(逆)(填“ >”、“ < ”或"="),理由是:________________________________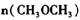 =__________________ ,平衡时CO的转化率= ______________ 。
=__________________ ,平衡时CO的转化率= ______________ 。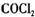 俗名¥作光气,是有毒气体。在一定条件下,可发生的化学反应为:
俗名¥作光气,是有毒气体。在一定条件下,可发生的化学反应为:
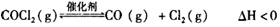 下列有关说法正确的是
下列有关说法正确的是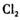 的物质的量比为1:1时,反应达到平衡状态
的物质的量比为1:1时,反应达到平衡状态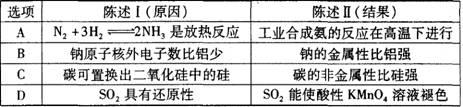
 的醋酸钠和醋酸混合溶液中:
的醋酸钠和醋酸混合溶液中: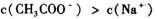
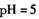 的氯化钠和稀硝酸的混合溶液中,
的氯化钠和稀硝酸的混合溶液中,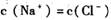
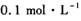 的硫化钠溶液中,•
的硫化钠溶液中,•